
La microhélice autorresonante. (A) Una microhélice de cinco vueltas fabricada envuelta alrededor de un capilar de 0,4 mm de diámetro exterior. Durante la fabricación, la microhélice se enrolla firmemente alrededor de una broca de 0,4 mm y se pega dentro de un cilindro Rexolite. Se quita la broca, y el pegamento se deja secar durante varios días. El conjunto de microhélice se coloca en (B) un conjunto de acoplamiento y soporte, que incluye un microacoplador plano. (C) El microacoplador plano consta de una impedancia de línea de banda que coincide con un bucle de acoplamiento inductivo. SMA, Versión en subminiatura A. (D) Simulaciones de modelado de elementos finitos del campo magnético de microondas, normalizado a la potencia de entrada, a 9,5 GHz muestran una región activa de buena homogeneidad del campo magnético en una altura de 0,8 mm. El campo magnético de microondas medido de 3,2 G / W1 / 2 corresponde a un pulso π / 2 de 20 ns a aproximadamente 20 mW. Dimensiones de la microhélice, donde la autorresonancia está determinada por la capacitancia formada entre cada vuelta y la inductancia de los devanados, son exhibidos. La frecuencia se puede sintonizar durante la fabricación por el número de vueltas, el tono de las vueltas, o el diámetro interior. Crédito:Science Advances, doi:10.1126 / sciadv.aay1394
Los bioquímicos pueden utilizar la resonancia paramagnética de electrones (EPR) en monocristales de proteínas para determinar la estructura electrónica última de los intermedios de proteínas paramagnéticas e investigar el tensor magnético relativo de una estructura molecular. El método es, sin embargo, retenido por las dimensiones típicas de los cristales de proteínas (0,05 a 0,3 mm) que no proporcionan suficiente intensidad de señal durante la cristalografía de proteínas. En un nuevo estudio sobre Avances de la ciencia , Jason W. Sidabras y un equipo de investigación interdisciplinario en los departamentos de Conversión de Energía Química, Fotobiotecnología, El Instituto de Biología y Física Experimental de Alemania presentó una microhélice autorresonante de microondas para cuantificar muestras de nanolitros. Los científicos implementaron la técnica en un espectrómetro EPR comercial de banda X (frecuencia de rango medio; 9,5 GHz). La microhélice autorresonante proporcionó una mejora medida de señal a ruido en comparación con otros resonadores EPR comerciales. El trabajo permite técnicas avanzadas de EPR para estudiar monocristales de proteínas para cristalografía de rayos X, sin exclusiones o desafíos relacionados con el tamaño. Para demostrar el método, Sidabras et al. usó proteína de cristal único [FeFe] -hidrogenasa (de Clostridium pasteurianum ) con dimensiones de 0,3 mm por 0,1 mm por 0,1 mm.
El autor principal Jason W. Sidabras, Actualmente es becaria de acciones Marie Sklowdowska-Curie en el Instituto Max Planck para la Conversión de Energía Química en Alemania, comentó además sobre el trabajo realizado con los colegas investigadores, el profesor Wolfgang Lubitz y el Dr. Edward J. Reijerse. "Aunque comenzamos con [FeFe] -hidrogenasa aquí, Hemos tratado de investigar la dinámica de EPR monocristalino durante años y la tecnología actual no se limita solo a los metales de transición. El método definido en el estudio es aplicable para monitorear cualquier actividad enzimática dentro de un intermedio de proteína estable ". Señaló además su objetivo de utilizar la tecnología para reducir los costos existentes de la tecnología EPR de pulso y reemplazar los costosos amplificadores de alta potencia para la ciencia frugal (económicamente estrategias rentables en ciencia).
Los científicos suelen utilizar la espectroscopia EPR para investigar el ciclo catalítico de las enzimas redox que contienen intermedios paramagnéticos y obtener información sobre la estructura electrónica y geométrica de un sitio enzimático activo. Generalmente, para realizar experimentos de EPR en proteínas, los investigadores preparan una solución congelada (concentración entre 0,1 a 1 mM) y colocan un volumen (200 µl) en una cavidad de microondas para obtener interacciones magnéticas en un sitio activo, con vista limitada de la estructura electrónica. Para resolver completamente los parámetros de interacción magnética del tensor, deben realizar experimentos de EPR de cristal único donde los tensores de interacción magnética se pueden combinar con cristalografía de rayos X para demostrar la geometría de las proteínas y comprender los mecanismos catalíticos de las enzimas. Sin embargo, El EPR monocristalino rara vez se aplica a sistemas de proteínas debido a los desafíos de obtener cristales con volúmenes y tamaños adecuados. Muchas proteínas en el rango de 0,05 a 0,3 mm son demasiado pequeñas para el análisis con instrumentación comercial EPR.
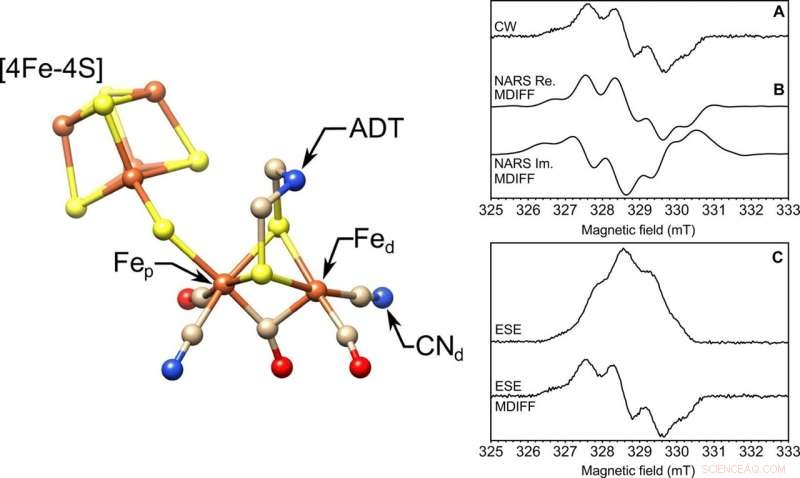
IZQUIERDA:La estructura molecular del sitio activo [FeFe] -hidrogenasa, el grupo H. Se destacan los hierros proximal y distal, Fep y Fed, respectivamente, el ligando de cianuro (CN − d), y el ligando ADT. S, amarillo; Fe, naranja; NORTE, azul; C, broncearse; Oh rojo. La estructura es de Protein Data Bank (PDB) ID 4XDC. DERECHA:Solución congelada EPR en una muestra de volumen de 85 nl en la banda X. Se realizaron tres experimentos de EPR con una microhélice autorresonante de 0,4 mm de diámetro interno. Se muestran la (A) onda continua (CW), (B) escaneo rápido no adiabático real (Re.) E imaginario (Im.) (NARS), y (C) experimentos ESE EPR de barrido de campo de dos pulsos del radical tirosina D (Y ∙ D) en el fotosistema II con 85 nl de muestra de solución congelada a una temperatura de 80 K. Se muestra 0,5 mT para los experimentos NARS y ESE de barrido de campo para comparar directamente con el experimento EPR de onda continua. El tiempo total para los experimentos fue 49, 55, y 45 min, respectivamente. La relación señal-ruido se calcula y tabula. Crédito:Science Advances, doi:10.1126 / sciadv.aay1394.
Para mejorar la sensibilidad de EPR para estudiar monocristales, típicamente en la banda X, los investigadores deben abandonar el diseño de la cavidad de microondas y pasar a resonadores de pequeño volumen en el rango de las microondas. La estrategia puede facilitar volúmenes de muestra reducidos de 200 a 20 µl usando un resonador de bucle-gap (LGR) y reducciones adicionales con materiales de alta constante dieléctrica para reducir el volumen activo a un microlitro. Las investigaciones de cristales únicos de proteínas requieren reducciones de volumen aún mayores (menos de 0,03 µl) y eso requiere un enfoque radical. Para lograr esto, Sidabras et al. combinó una microhélice autorresonante y un microacoplador plano en una configuración de placa de circuito impreso, que impulsó la microhélice autorresonante colocada en el centro del bucle de acoplamiento. La geometría de microhélice ofrecía ventajas con una homogeneidad de campo de microondas muy mejorada y una mayor sensibilidad de volumen para muestras pequeñas en comparación con otros microrresonadores. El equipo optimizó la microhélice autorresonante para experimentos de pulso y onda continua que requieren muy poca potencia de microondas. Hicieron coincidir y sintonizar fácilmente la microhélice en una variedad de muestras y temperaturas.
En el presente trabajo, El equipo utilizó la microhélice autorresonante para investigar la rotación del cristal EPR de la [FeFe] -hidrogenasa en el estado oxidado activo (H BUEY ; dimensiones del cristal 3 mm por 0,1 mm por 0,1 mm), de Clostridium pasteurianum (bacteria anaeróbica). Realizaron experimentos avanzados de EPR de pulso en la estructura para observar una excelente relación señal-ruido. Los datos demostraron el uso de la microhélice para estudiar proteínas monocristalinas en volúmenes apropiados para la cristalografía de rayos X. Durante los experimentos, El equipo de investigación envolvió la geometría de microhélice autorresonante alrededor de un capilar de 0,4 mm y unió el conjunto a un inserto personalizado compatible con los sistemas EPR comerciales. Llevaron a cabo un experimento EPR de onda continua utilizando una solución congelada y mejoraron la relación señal / ruido (SNR) del trabajo utilizando un experimento de barrido rápido no adiabático (NARS) de barrido de campo.
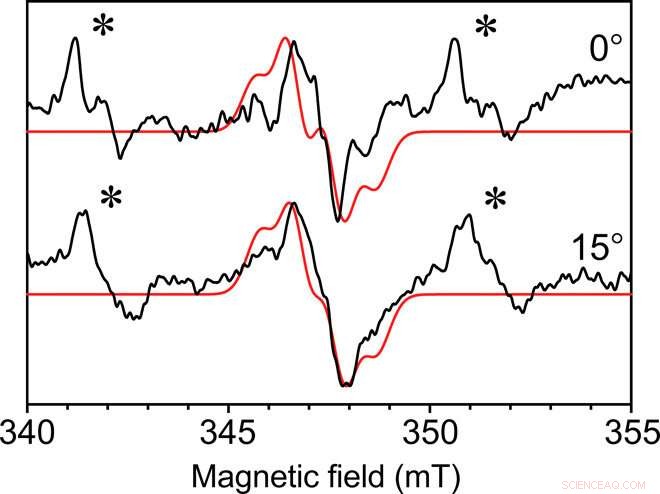
EPR monocristalino de onda continua de Y ∙ D en el complejo del núcleo del fotosistema II. EPR de onda continua recogido con la microhélice autorresonante de 0,4 mm de diámetro interno en dos ángulos del radical fotosistema II Y ∙ D de un monocristal a una temperatura de 80 K. Las dimensiones del cristal eran de 0,3 mm por 0,18 mm por 0,18 mm. Se muestra en rojo una simulación ajustada con características similares. Una señal de Mn2 + unida inespecíficamente también está presente en las aguas madres del cristal, indicado por un asterisco (∗). Cada espectro se recopiló en 49 minutos con una relación señal / ruido de aproximadamente 35. Crédito:Science Advances, doi:10.1126 / sciadv.aay1394.
Utilizaron un radical de tirosina D de larga duración (Y ∙ D) como sonda estándar durante experimentos con propiedades previamente bien caracterizadas. Para generar la señal EPR del radical tirosina (Y ∙ D), El equipo iluminó muestras del complejo central del fotosistema II (complejo de proteína de membrana) con luz ambiental y las congeló rápidamente. Llevaron a cabo múltiples experimentos para demostrar la versatilidad de la microhélice durante las mediciones de EPR en una variedad de muestras (menos de 85 nanolitros en volumen) en la banda X. Sidabras et al. utilizó los cristales del fotosistema II como punto de referencia a pesar de su constitución desafiante. Estructuralmente el complejo del fotosistema II contenía una masa molecular de aproximadamente 350 kDa y cada componente contenía solo un radical Y ∙ D. En total, con ocho complejos del fotosistema II por celda unitaria, los científicos calcularon 8,9 x 10 12 Radicales Y ∙ D, demostrar la versatilidad del método EPR para estudiar grandes complejos en pequeñas dimensiones de cristal.
Después de establecer la idoneidad de la microhélice autorresonante para estudiar muestras de proteína monocristalina, el equipo extendió el trabajo para demostrar la determinación del tensor g angular completo (cambio de energía asociado con la transición molecular) y para examinar experimentos avanzados de EPR de pulso, como la modulación de envolvente de eco de espín de electrones (ESEEM) o la correlación de subnivel hiperfina (HYSCORE). Optimizaron la microhélice autorresonante para estos experimentos. El equipo realizó experimentos de EPR de barrido de campo de dos pulsos ESE (eco de espín de electrones) en un monocristal de proteína de la [FeFe] -hidrogenasa de C. pasteurianum (Cpl) en el H oxidado BUEY estado en una cámara anaeróbica bajo un microscopio para absorber cristales de proteína a través de la acción capilar en un tubo capilar.

Pulse EPR en un monocristal del grupo H en [FeFe] -hidrogenasa. (A) La estructura molecular del sitio activo [FeFe] -hidrogenasa, el grupo H, de PDB ID 4XDC se muestra con el marco molecular ubicado con el hierro distal (Fed) como origen. S, amarillo; Fe, naranja; NORTE, azul; C, broncearse; Oh rojo. (B) El esquema de simetría P1211 que relaciona el marco molecular (x, y, z) al marco de cristal (a, B, c) y, último, al bastidor del sistema de laboratorio (L1, L2, L3) se muestra. Los dos marcos moleculares de la unidad asimétrica están presentes en el Sitio I y pueden trasladarse al Sitio II mediante operaciones de simetría cristalina. (C) El campo magnético estático (B0) se coloca a lo largo del eje L1, mientras que el campo magnético de microondas (B1) puede estar a lo largo del eje L2 o a lo largo del eje L3. Es factible una rotación de 180 ° alrededor del eje L3, pero solo una rotación parcial alrededor del eje L2 es factible debido a que B1 gira con el cristal, lo que hace que B1 se vuelva paralelo a B0. Una tercera rotación parcial es factible si la muestra se gira 90 ° alrededor del eje L2. (D) Experimentos de EPR de pulso recopilados con la microhélice autorresonante de 0,4 mm de diámetro interno con un cristal único de [FeFe] -hidrogenasa de C. pasteurianum (CpI) en el estado Hox que muestran los datos recopilados en un plano para una rotación completa de 180 ° en pasos de 5 ° a una temperatura de 15 K. Las dimensiones del cristal eran de aproximadamente 0,3 mm por 0,1 mm por 0,1 mm, y cada espectro se recopiló en 8 minutos con una relación señal / ruido de aproximadamente 290. (E) Una vista estéreo del tensor g analizado (gx, rojo; gy verde; y gz, azul) está mapeado en la estructura cristalina (ID de PDB:4XDC). Para una vista tridimensional (3D) del tensor g propuesto, ver https://act-epr.org/FeFeHydrogenase.html. Crédito:Science Advances, doi:10.1126 / sciadv.aay1394.
Luego incluyeron crioprotectores y medios en la microhélice seguido de congelación instantánea para producir una señal EPR con cuatro señales distintas en el espectro en relación con la estructura de la proteína. Los científicos ajustaron los datos en simulaciones relacionadas con diferentes marcos de referencia definidos a través del paquete de simulación EasySpin para la simulación del espectro EPR. El equipo creó un esquema que relaciona el marco molecular del clúster H de [FeFe] -hidrogenasa con el marco del sistema de laboratorio. Para todas las especies examinadas en los experimentos, el equipo determinó la magnitud y la orientación del tensor g utilizando la teoría del campo de ligando y verificó los resultados utilizando cálculos químicos cuánticos. El equipo facilitó conocimientos fundamentales sobre la estructura electrónica y notó su dependencia de la esfera del ligando y observó la necesidad de estrategias optimizadas.
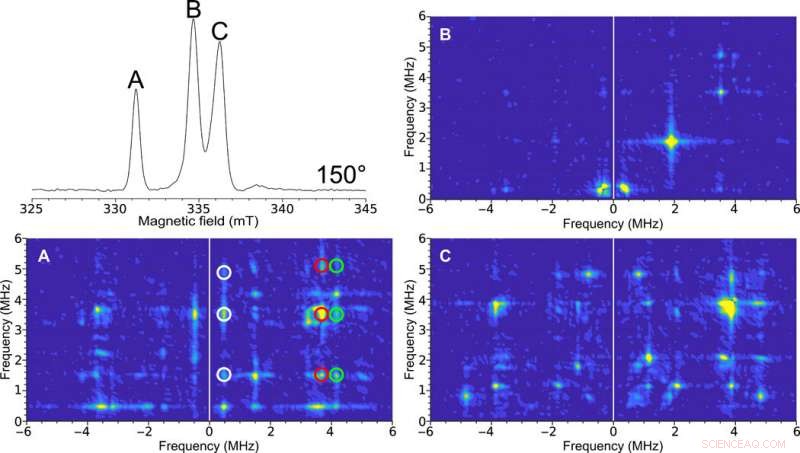
HYSCORE EPR monocristalino del grupo H en [FeFe] -hidrogenasa. Arriba a la izquierda:espectro ESE EPR de dos pulsos barrido en campo a 150 °. Las etiquetas de las figuras (A, B, y C) son representativos de los picos espectrales. Los espectros HYSCORE recogidos con la microhélice autorresonante de 0,4 mm de diámetro interno de un monocristal de [FeFe] -hidrogenasa de C. pasteurianum (CpI) en el estado Hox con una orientación de 150 ° recogidos a una temperatura de 15 K. El 2D La representación de densidad muestra correlaciones entre las transiciones de espín nuclear en ambas proyecciones del espín electrónico. (A) Limpie el espectro HYSCORE debido al pico correspondiente a solo una de las señales EPR en la celda unitaria del cristal. Las características correlacionadas entre estas transiciones están indicadas por el blanco, rojo, y círculos verdes. (B) El espectro HYSCORE relativamente sin características sugiere poca interacción hiperfina en esta orientación. (C) HYSCORE en dos señales EPR superpuestas que representan diferentes orientaciones de la molécula de enzima con respecto al campo magnético. HYSCORE se configuró utilizando el asistente Bruker HYSCORE con la siguiente configuración:π / 2, 40 ns; τ, 280 ns; y Δτ, 48 ns with 256 points each and 20 shots per point. Each HYSCORE spectrum was collected in approximately 1 hour. Crédito:Science Advances, doi:10.1126/sciadv.aay1394.
The researchers illustrated more advanced experiments for single-crystal studies using HYSCORE (hyperfine sublevel correlation) experiments for the ESE (electron spin echo) EPR dataset. Para esto, they obtained a single-crystal 2-D spectrum for the H-cluster in [FeFe]-hydrogenase crystals and identified six main transitions. Sidabras et al. highlighted the feasibility of these advanced EPR techniques in the present work and related them to the electronic structure predicted using quantum chemical calculations. The team aim to address additional molecular couplings of ligands in depth using ESEEM/HYSCORE techniques in the future.
De este modo, Jason W. Sidabras and colleagues presented an advanced resonator to design and collect EPR data from a 3 mm by 0.1 mm by 0.1 mm single crystal of [FeFe]-hydrogenase in the H BUEY state from C. pasteurianum (Cpl). The HYSCORE spectra obtained from a protein single crystal in the present work were a first in study. Additional work proposed by the team will facilitate further insight for protein engineering and artificial enzyme research to create bioinspired and biomimetic enzymatic systems. Notablemente, the self-resonant microhelix engineered in the work can allow biochemists to study diverse catalytically active proteins at crystal dimensions relative to X-ray crystallography, which will pave the way for significant advancements in the field of enzyme research.
© 2019 Science X Network