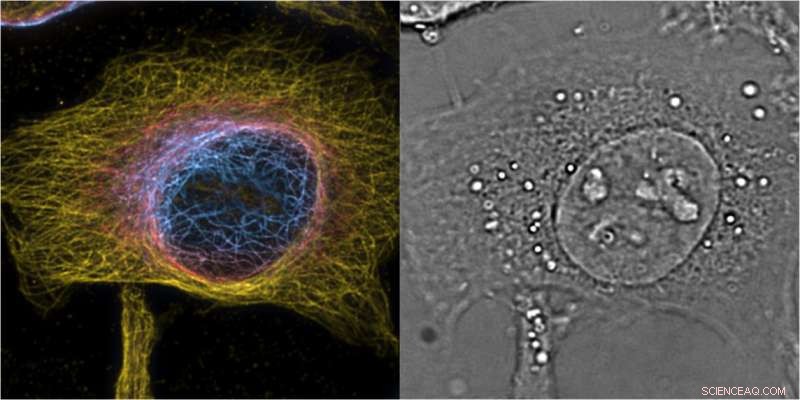
Proyección de intensidad máxima de células HeLa de bSOFI 3D de segundo orden de microtúbulos marcados, el color codifica la posición z con una porción de la imagen de fase 3D complementaria que proporciona contexto celular. Crédito:T. Lasser / EPFL
La microscopía de superresolución es una técnica que puede "ver" más allá de la difracción de la luz, proporcionando vistas sin precedentes de las células y sus estructuras interiores y orgánulos. La técnica ha despertado un interés creciente recientemente, especialmente desde que sus desarrolladores ganaron el Premio Nobel de Química en 2014.
Pero la microscopía de súper resolución tiene una gran limitación:solo ofrece resolución espacial. Eso podría ser suficiente para muestras estáticas, como materiales sólidos o celdas fijas, pero cuando se trata de biología, las cosas se vuelven más complicadas. Las células vivas son muy dinámicas y dependen de un conjunto complejo de procesos biológicos que ocurren en escalas de tiempo inferiores a un segundo. cambiando constantemente. Entonces, si queremos visualizar y comprender cómo funcionan las células vivas en la salud y la enfermedad, también necesitamos una resolución de tiempo alta (o "temporal").
Un equipo dirigido por el profesor Theo Lasser, El director del Laboratorio de Óptica Biomédica (LOB) de la EPFL ha avanzado mucho para abordar el problema mediante el desarrollo de una técnica que puede realizar tanto microscopía de superresolución 3-D como imágenes rápidas de fase 3-D en un solo instrumento. La formación de imágenes de fase es una técnica que traduce los cambios en la fase de la luz causados por las células y sus orgánulos en mapas de índice de refracción de las propias células.
La plataforma única, que se conoce como microscopio 4-D, combina la sensibilidad y la alta resolución temporal de las imágenes de fase con la especificidad y la alta resolución espacial de la microscopía de fluorescencia. Los investigadores desarrollaron un algoritmo novedoso que puede recuperar la información de fase de una pila de imágenes de campo brillante tomadas con un microscopio clásico.

PRISM:complemento de microscopía para realizar imágenes 3D simultáneas de 8 planos. Crédito:Vytautas Navikas
"Con este algoritmo, presentamos una nueva forma de lograr microscopía de fase cuantitativa 3-D utilizando un microscopio de campo claro convencional, "dice Adrien Descloux, uno de los autores principales del artículo. "Esto permite la visualización y el análisis directos de las estructuras subcelulares en las células vivas sin etiquetado".
Para lograr imágenes tridimensionales rápidas, los científicos diseñaron a medida un prisma de división de imágenes, que permite la grabación simultánea de una pila de ocho imágenes desplazadas en z. Esto significa que el microscopio puede realizar imágenes de fase tridimensional de alta velocidad en un volumen de 2,5 μm x 50 μm x 50 μm. La velocidad del microscopio está básicamente limitada por la velocidad de su cámara; para esta demostración, el equipo pudo obtener imágenes de la dinámica intracelular hasta a 200 Hz. "Con el prisma como complemento, puede convertir un microscopio clásico en un generador de imágenes 3D ultrarrápido, "dice Kristin Grussmayer, otro de los autores principales del artículo.
El prisma también es adecuado para imágenes de fluorescencia 3-D, que los científicos probaron utilizando imágenes de fluctuación óptica de superresolución (SOFI). Este método aprovecha el parpadeo de los tintes fluorescentes para mejorar la resolución tridimensional a través del análisis de correlación de la señal. Usando esto, los investigadores realizaron imágenes de superresolución 3-D de estructuras teñidas en las células, y lo combinó con imágenes de fase sin etiquetas 3-D. Las dos técnicas se complementaron muy bien, revelando imágenes fascinantes de la arquitectura interior, citoesqueleto y orgánulos también en células vivas en diferentes puntos de tiempo.
"Estamos encantados con estos resultados y las posibilidades que ofrece esta técnica, "dice el profesor Hilal Lashuel, cuyo laboratorio en EPFL se asoció con el del profesor Lasser en el uso de la nueva técnica para estudiar los mecanismos por los cuales la agregación de proteínas contribuye al desarrollo y progresión de enfermedades neurodegenerativas, como el Parkinson y el Alzheimer. "Los avances técnicos permitieron la visualización de alta resolución de la formación de agregados patológicos de alfa sinucleína en las neuronas del hipocampo".
El equipo ha denominado PRISM a la nueva plataforma de microscopía, para instrumento de recuperación de fase con microscopía de superresolución. "Ofrecemos PRISM como una nueva herramienta de microscopía y anticipamos que se utilizará rápidamente en la comunidad de las ciencias de la vida para ampliar el alcance de la obtención de imágenes en 3D de alta velocidad para investigaciones biológicas". ", dice Theo Lasser." Esperamos que se convierta en un caballo de batalla habitual para la neurociencia y la biología ".