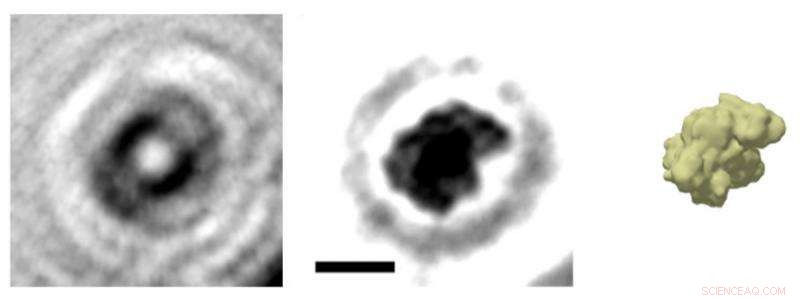
Una imagen holográfica de una sola proteína:la imagen de la proteína albúmina (centro) se calcula a partir del holograma (izquierda). En principio, es como si se trazaran las ondas que genera una piedra arrojada al agua para reconstruir la forma de la piedra. Como muestra una comparación con una simulación de densidad electrónica, la representación holográfica reproduce la estructura global de la proteína con mucha precisión. Crédito:Jean-Nicolas Longchamp / Universidad de Zúrich
Las proteínas son las herramientas de la vida. En el futuro, los científicos pueden examinar moléculas individuales con un método especialmente suave para determinar cómo se construyen, cómo realizan sus funciones en las células, y cómo interactúan con fármacos potenciales. Esto es posible gracias a los hologramas de proteínas que, por primera vez, han producido utilizando electrones muy lentos por científicos de la Universidad de Zúrich y el Instituto Max Planck para la Investigación Estatal So lid en Stuttgart.
Conocer la estructura de las proteínas es de interés no solo para los biólogos que quieren comprender cómo funciona un organismo, sino también para los médicos y farmacólogos que necesitan saber cómo se construyen las proteínas. cómo interactúan con otras proteínas y moléculas más pequeñas, y cómo esos sitios de unión cambian a medida que la proteína realiza sus funciones. Con este conocimiento, los investigadores pueden desarrollar medicamentos que interactúen con la maquinaria de las proteínas cuando se descompone y enfermamos.
La capacidad de obtener imágenes de proteínas individuales podría ser extremadamente útil:los métodos comunes como el análisis de la estructura de rayos X y la microscopía crioelectrónica requieren cristales de las biomoléculas o una gran cantidad de una proteína. Una deficiencia de estos métodos es que los cristales de muchas proteínas son imposibles de cultivar. Es más, debido al promedio, las técnicas a menudo no detectan diferencias entre varias conformaciones, es decir, variantes estructurales, de la biomolécula. Sin embargo, son precisamente estas variaciones las que son importantes en la búsqueda de nuevos fármacos, ya que las proteínas asumen diversas conformaciones cuando realizan sus funciones.
La idea original de la holografía ahora es una realidad.
"Ahora hemos obtenido imágenes de proteínas individuales por primera vez, "dice Hans-Werner Fink, profesor de la Universidad de Zúrich y director del experimento. "Esto se logró mediante la combinación de dos métodos que son únicos en el mundo científico:la holografía electrónica y la deposición por haz de iones por electropulverización, lo que permite que las muestras se preparen con mucha suavidad ". Con esta combinación, los investigadores han generado hologramas de citocromo C, albúmina y hemoglobina. Como ya se conocen las estructuras de estas proteínas, los investigadores pudieron usarlos para confirmar la precisión y utilidad de los hologramas.
Para la holografía electrónica, Los investigadores del grupo de Hans-Werner Fink con sede en Zurich han desarrollado un microscopio innovador que explota las propiedades ondulatorias de los electrones. El microscopio irradia electrones de baja energía a través de una proteína y superpone los electrones dispersos con la parte del haz de electrones que no ha interactuado con la proteína. El patrón de interferencia resultante, que puede ser registrado por el microscopio, forma un holograma similar a los obtenidos por holografía óptica. "Debido a que los electrones tienen muy poca energía, hay muy poco daño por radiación, incluso si imaginamos una proteína durante horas, a diferencia de otros métodos de análisis estructural, "explica Hans-Werner Fink.
Con el microscopio de holografía electrónica, el físico se ha dado cuenta de la idea original de Dennis Gábor. Cuando el ingeniero británico-húngaro inventó la holografía en 1947, de hecho, tenía en mente un microscopio electrónico mejorado. Sin embargo, en ese momento no había fuentes de electrones adecuadas, así que eso, siguiendo la invención del láser, este nuevo principio de formación de imágenes ópticas solo podría ponerse en práctica con luz. Dennis Gábor recibió el Premio Nobel de Física en 1971. "Después de la invención de una fuente puntual de electrones ultranítida, que emite electrones con propiedades similares a las de una luz láser, finalmente nos dimos cuenta de la brillante idea de Dennis Gábor con ondas de electrones, "dice Hans-Werner Fink.
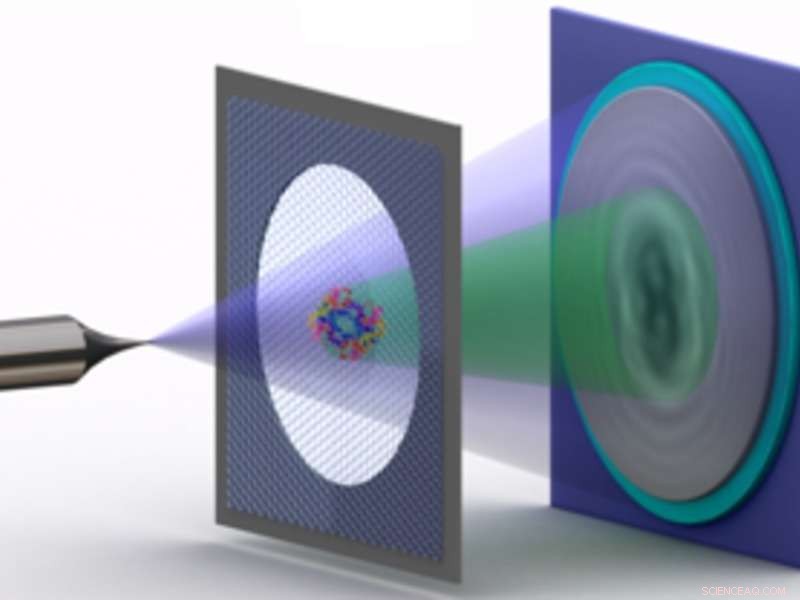
Diagrama que muestra la holografía electrónica de proteínas individuales:una punta de metal cuyo extremo se estrecha a unos pocos átomos emite un haz de luz relativamente lento, es decir., electrones de baja energía. Parte del haz es esparcido por la proteína en un portador de grafeno. La parte dispersa del haz genera un patrón de interferencia con la parte no dispersa, el holograma, que se registra. Crédito:Tatiana Latychevskaia / Universidad de Zúrich
La proteína gaseosa se coloca suavemente sobre grafeno.
Sin embargo, para obtener imágenes de proteínas individuales con holografía electrónica, los investigadores suizos todavía necesitaban un material portador para las proteínas que sea transparente a las ondas de electrones, así como un método para colocar biomoléculas sin causar daños. El grafeno resultó ser el material más adecuado para el soporte. Investigadores del Instituto Max Planck para la Investigación del Estado Sólido encontraron la mejor solución para depositar proteínas en las láminas formadas por capas de carbono:deposición por haz de iones por electropulverización, que fue desarrollado por un equipo encabezado por Stephan Rauschenbach en el departamento de Klaus Kern. Los investigadores exponen la solución de proteína a un alto voltaje eléctrico para que el líquido esté muy cargado. La repulsión eléctrica hace que el líquido se atomice en una fina niebla. Cuando las gotas de niebla se exponen al vacío, el líquido se evapora y los componentes disueltos, es decir, proteínas e impurezas, permanecen atrás como gases. Luego, un espectrómetro de masas clasifica las proteínas de acuerdo con sus proporciones de masa a carga y también separa las impurezas.
"Nuestro método permite transferir moléculas biológicas individuales al vacío y depositarlas en una superficie con tanta suavidad que se conserva su frágil estructura proteica plegada tridimensional". ", dice Stephan Rauschenbach." Gracias a la espectrometría de masas preparativa, también evitamos la contaminación de las muestras de grafeno con otras moléculas, lo cual es crucial para la calidad de la imagen holográfica ”. La espectrometría de masas también hace posible separar mezclas de proteínas o proteínas puras de complejos con compañeros de unión.
Información sobre el ensamblaje de subunidades.
Una vez que Stephan Rauschenbach y sus colegas depositaron las proteínas en los sustratos de grafeno en Stuttgart, las muestras deben ser transportadas a Zurich, donde se encuentra el microscopio holográfico de electrones. Las muestras deben llegar en un estado no contaminado, lo que significa que no se puede permitir que otras moléculas se asienten en el grafeno. Para transportar las muestras a Suiza, los investigadores han desarrollado un caso en el que prevalece un vacío ultra alto, como en el propio aparato.
Gracias sobre todo al meticuloso cuidado y limpieza observados durante la preparación y transporte de las muestras, los hologramas de electrones ya alcanzan una resolución de menos de un nanómetro. "Esto nos permite investigar cómo se ensamblan las subunidades individuales de grandes complejos de proteínas, ", Dice Stephan Rauschenbach. Los primeros hologramas de proteínas individuales también proporcionan información sobre su estructura tridimensional.
"Sin embargo, para obtener imágenes con precisión de las estructuras de proteínas a nivel atómico, todavía tenemos que mejorar un poco la resolución, "explica Klaus Kern.", no hay obstáculos físicos que lo impidan ". Los científicos con sede en Zúrich y Stuttgart ahora planean construir un microscopio en el que se supriman las vibraciones de las proteínas enfriando las muestras a alrededor de menos 200 grados Celsius. Además, Recientemente se ha construido un laboratorio de precisión único en el Instituto Max Planck en Stuttgart, que ofrece las condiciones perfectas para mediciones altamente sensibles como la holografía. Este laboratorio fue construido por iniciativa de Klaus Kern y actualmente es el estándar de oro para un entorno de medición de baja vibración. Tan pronto como se haya optimizado el microscopio de holografía electrónica, Los científicos biomédicos pueden utilizar este nuevo instrumento para estudiar las complejidades de cómo funcionan las herramientas de la vida.