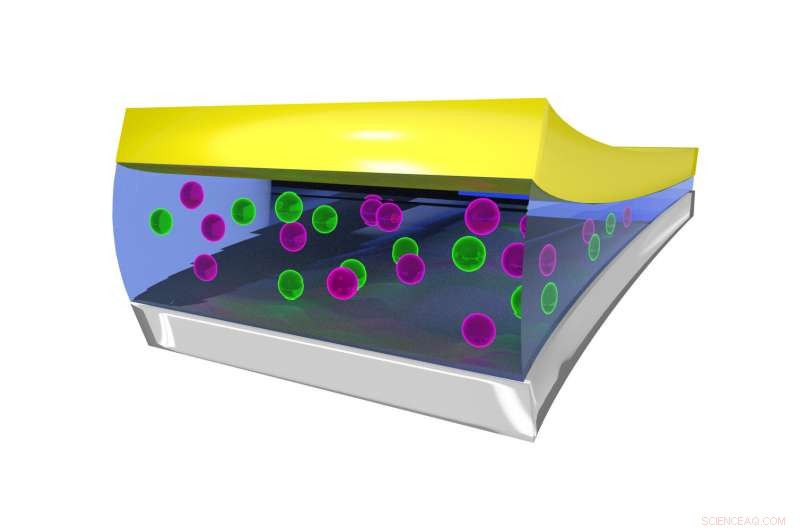
Imagen fija que muestra el entorno de coordinación del ion F en el electrolito líquido, estabilizado por moléculas de BTFE. Crédito:Dr. Brett Savoie - Caltech / Perdue
Imagínese no tener que cargar su teléfono o computadora portátil durante semanas. Ese es el sueño de los investigadores que buscan baterías alternativas que vayan más allá de las versiones actuales de iones de litio populares en la actualidad. Ahora, en un nuevo estudio que aparece en la revista Ciencias , químicos en varias instituciones, incluyendo Caltech y el Jet Propulsion Laboratory, que es administrado por Caltech para la NASA, así como el Instituto de Investigación Honda y el Laboratorio Nacional Lawrence Berkeley, han descubierto una nueva forma de fabricar baterías recargables a base de flúor, la forma cargada negativamente, o anión, del elemento flúor.
"Las baterías de fluoruro pueden tener una mayor densidad de energía, lo que significa que pueden durar más, hasta ocho veces más que las baterías que se usan actualmente, "dice el coautor del estudio, Robert Grubbs, Victor y Elizabeth Atkins, profesora de Química de Caltech y ganadora del Premio Nobel de Química 2005. "Pero trabajar con el flúor puede ser un desafío, en particular porque es muy corrosivo y reactivo ".
En los 1970s, Los investigadores intentaron crear baterías de fluoruro recargables utilizando componentes sólidos, pero las baterías de estado sólido solo funcionan a altas temperaturas, haciéndolos poco prácticos para el uso diario. En el nuevo estudio, los autores informan que finalmente han descubierto cómo hacer que las baterías de fluoruro funcionen utilizando componentes líquidos, y las baterías líquidas funcionan fácilmente a temperatura ambiente.
"Todavía estamos en las primeras etapas de desarrollo, pero esta es la primera batería de fluoruro recargable que funciona a temperatura ambiente, "dice Simon Jones, químico del JPL y autor correspondiente del nuevo estudio.
Las baterías impulsan corrientes eléctricas transportando átomos cargados —o iones— entre un electrodo positivo y negativo. Este proceso de transporte avanza más fácilmente a temperatura ambiente cuando hay líquidos involucrados. En el caso de las baterías de iones de litio, el litio se transporta entre los electrodos con la ayuda de una solución líquida, o electrolito.
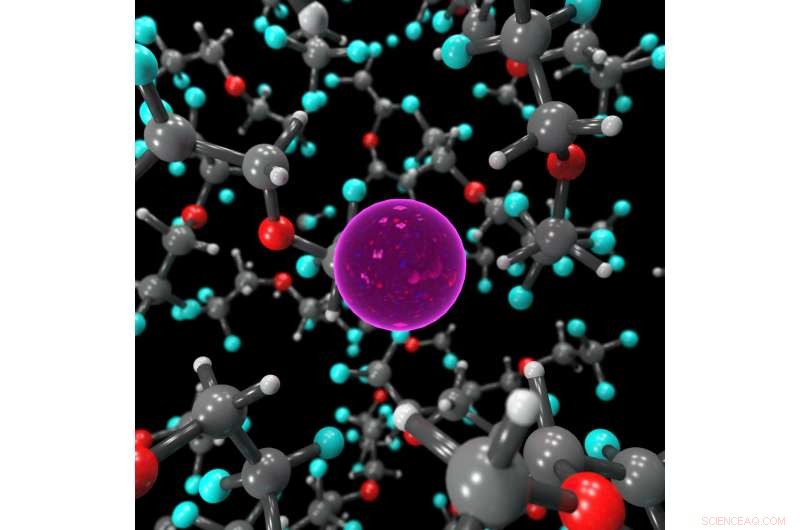
Imagen fija que muestra el entorno de coordinación del ion F en el electrolito líquido, estabilizado por moléculas de BTFE. Crédito:Dr. Brett Savoie - Caltech / Perdue
"Recargar una batería es como empujar una pelota cuesta arriba y luego dejarla rodar hacia atrás, una y otra vez, "dice el coautor Thomas Miller, profesor de química en Caltech. "Uno va y viene entre almacenar la energía y usarla".
Si bien los iones de litio son positivos (llamados cationes), los iones de fluoruro utilizados en el nuevo estudio tienen una carga negativa (y se denominan aniones). Existen tanto desafíos como ventajas al trabajar con aniones en baterías.
"Para una batería que dure más, necesita mover una mayor cantidad de cargas. Mover cationes metálicos con carga múltiple es difícil, pero se puede lograr un resultado similar moviendo varios aniones cargados individualmente, que viajan con relativa facilidad, "dice Jones, que investiga en el JPL sobre las fuentes de energía necesarias para las naves espaciales. "Los desafíos con este esquema son hacer que el sistema funcione con voltajes utilizables. En este nuevo estudio, demostramos que los aniones son realmente dignos de atención en la ciencia de las baterías, ya que demostramos que el fluoruro puede funcionar a voltajes suficientemente altos ".
La clave para hacer que las baterías de fluoruro funcionen en estado líquido en lugar de sólido resultó ser un electrolito líquido llamado bis (2, 2, 2-trifluoroetil) éter, o BTFE. Este solvente es lo que ayuda a mantener estable el ion fluoruro para que pueda transportar electrones hacia adelante y hacia atrás en la batería. Jones dice que su pasante en ese momento, Victoria Davis, que ahora estudia en la Universidad de Carolina del Norte, Chapel Hill, fue el primero en pensar en probar BTFE. Si bien Jones no tenía muchas esperanzas de que tuviera éxito, el equipo decidió intentarlo de todos modos y se sorprendió de que funcionara tan bien.
En ese punto, Jones se dirigió a Miller en busca de ayuda para comprender por qué funcionó la solución. Miller y su grupo realizaron simulaciones por computadora de la reacción y descubrieron qué aspectos de BTFE estaban estabilizando el fluoruro. Desde allí, el equipo pudo modificar la solución BTFE, modificándolo con aditivos para mejorar su rendimiento y estabilidad.
"Estamos desbloqueando una nueva forma de fabricar baterías de mayor duración, "dice Jones." El fluoruro está regresando a las baterías ".