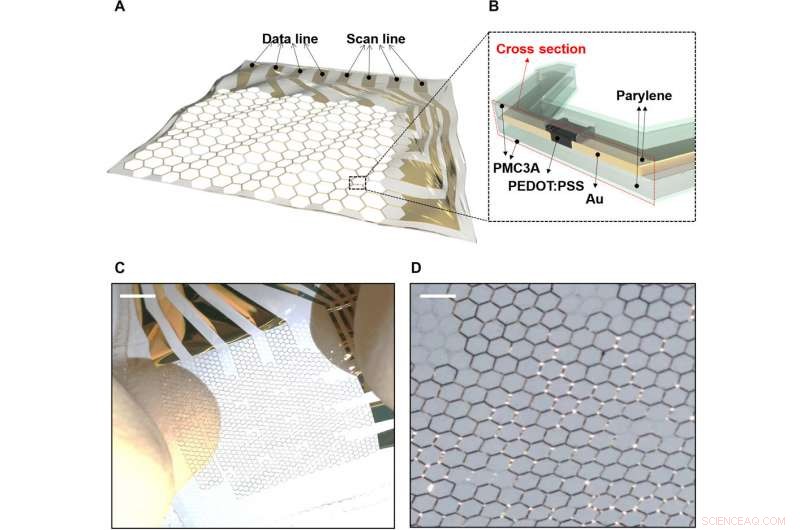
Matriz de OECT estirable sobre sustrato de rejilla de panal. A) La matriz OECT electrofisiológica extensible sobre un sustrato de parileno de rejilla de panal. B) Sección transversal de la matriz OECT extensible. C) Una matriz OECT extensible de 4 x 4 cuando se estira intrínsecamente. D) Vista ampliada de la matriz OECT extensible de 4 x 4 cuando se estira. Crédito:Science Advances, doi:10.1126 / sciadv.aau2426
Para evaluar funciones fisiológicas in vivo, Las señales electrofisiológicas deben monitorearse con alta precisión y alta resolución espacial o temporal. Ultraflexible, Las matrices de multielectrodos (MEA) se fabricaron recientemente para establecer un contacto conforme en las superficies de los órganos y medir la propagación de la señal electrofisiológica a una alta resolución espacio-temporal. Sin embargo, Los sustratos plásticos con un módulo de Young alto incorporado en el proceso causaron dificultades durante la implantación debido a la hemodinámica basada en el movimiento dinámico en la superficie del corazón. En un nuevo estudio publicado en Avances de la ciencia , Wonryung Lee y sus colegas han desarrollado un MEA activo fabricado para demostrar la no trombogenicidad, estirabilidad y estabilidad. Las matrices permitieron la monitorización electrocardiográfica (ECG) a largo plazo en los corazones palpitantes de ratas, incluso con sangrado capilar. Las señales de ECG medidas exhibieron una alta relación señal / ruido (SNR) de 52 dB como resultado de la lectura de datos activa.
En el estudio, El novedoso MEA extensible se diseñó cuidadosamente utilizando técnicas de ingeniería de vanguardia. Los métodos combinaron transistores electroquímicos orgánicos (OECT) de ganancia extraordinariamente alta procesados en sustratos de microrred con un recubrimiento de poli (acetato de 3-metoxipropilo) (PMC3A). El proceso facilitó importantes propiedades antitrombóticas al tiempo que mantuvo una excelente conductividad iónica.
Típicamente, Las matrices de electrodos múltiples (MEA) se utilizan para investigar la posición de las células activas / inactivas, propagación de señales neuronales y redes entre múltiples neuronas. Las matrices también se pueden usar para diagnosticar y tratar enfermedades midiendo señales biológicas en múltiples puntos. El primer MEA in vitro informado se fabricó en vidrio plano para medir la excitación celular en el miocardio cultivado, células neuronales y propagación de señales de cortes de corazón y cerebro. Las matrices de MEA in vivo no invasivas desarrolladas recientemente se fabricaron en una lámina de plástico flexible con la capacidad de entrar en contacto con tejidos vivos blandos y en movimiento. Durante el proceso de ingeniería, la flexibilidad del dispositivo debe aumentarse para facilitar los MEA en estructuras complejas del cuerpo durante la implantación.
Contacto conformado en superficies cerebrales arrugadas, por ejemplo, se puede lograr reduciendo el grosor del dispositivo por debajo de dos µm. Similar, Las mediciones de ECG se pueden realizar en la piel cercana al corazón mediante MEA pasivos en sustratos de poliimida de 3 µm. Las propiedades ultraflexibles de los MEA activos se demostraron mediante el contacto suave con las células musculares, corteza cerebral, así como mediciones de electromiografía (EMG) y electrocorticografía (ECoG). Un MEA activo estirable y compatible con la sangre aún no se ha realizado debido a dos limitaciones principales. Al inicio, La degradación del dispositivo debido a coágulos de sangre por hemorragia quirúrgica como resultado de un módulo de Young alto se observó con polímeros de poliimida o parileno a pesar de su alta compatibilidad. Después de eso, También es difícil diseñar elementos activos de alto rendimiento con capacidad de estiramiento para medir señales biológicas. Los elementos activos también requerían altos factores de amplificación y bajos voltajes de excitación.
En el estudio, Lee y col. diseñado un ultrafino, matriz de OECT (transistor electroquímico orgánico) activo con patrón de cuadrícula extensible para medir la distribución de señales de ECG con una relación señal / ruido (SNR) de 52 dB a través del contacto directo en el corazón de rata que late. La matriz activa de 4 x 4 OECT se fabricó con un grosor total de 2,6 µm y una alta transconductancia. El dispositivo se revistió completamente con poli (acetato de 3-metoxipropilo) (PMC3A) de 100 nm de espesor para impartir propiedades antitrombóticas mientras se mantenía una excelente conductividad iónica. Se trazó un ECG de la superficie del corazón de una rata para determinar la viabilidad del 4 x 4, ultradelgado estirable matriz OECT antitrombótica y activa. Debido a la alta adaptabilidad de la estructura de la rejilla, el ruido de artefactos causado por el movimiento dinámico no apareció en los datos registrados. Además, debido a su propiedad antitrombótica, el dispositivo fue capaz de realizar mediciones estables durante largos períodos de tiempo, incluso en un entorno de implantes con sangrado constante.
Los sustratos de rejilla y OECTS extensibles que contienen MEA se fabricaron sobre sustratos de parileno de 1,2 µm. Las capas activas de un poli (3, El sistema de 4-etilendioxitiofeno) poliestireno sulfonato (PEDOT:PSS) y el cableado se realizaron sobre un sustrato de rejilla alveolar. La estructura de rejilla de panal permitió la estabilidad mecánica y la capacidad de estiramiento estructural, previamente investigado experimentalmente y mediante simulación. La capa más externa de PMC3A [poli (acetato de 3-metoxipropilo)] permitió una alta compatibilidad sanguínea para mantener la antitrombogenicidad. La capacidad de estiramiento del dispositivo permitió el movimiento dinámico sobre sustratos biológicos.
Antes de realizar experimentos biológicos in vivo, los autores evaluaron sistemáticamente el carácter eléctrico y mecánico del dispositivo. El rendimiento eléctrico se midió en relación con la transconductancia de la matriz, que indicó cantidades suficientemente grandes para medir las señales ECoG o EMG de ratas. El grosor y el ángulo de contacto con el agua de las superficies de PMC3A mostraron resultados consistentes con estudios anteriores. Se realizaron estudios de hemocompatibilidad en PMC3A utilizando la adhesión de plaquetas sumergiendo muestras en suspensiones de plaquetas extraídas de sangre humana. Se midió el tiempo de respuesta (τ) de los OECT antes y después del recubrimiento de PMC3A después de aplicar un pulso de voltaje de puerta con una duración de un milisegundo, lo que indica que el proceso de inmersión del PMC3A no cambió las propiedades eléctricas de OECT. Los PMC3A recubiertos con OECT también confirmaron la estabilidad eléctrica a largo plazo.
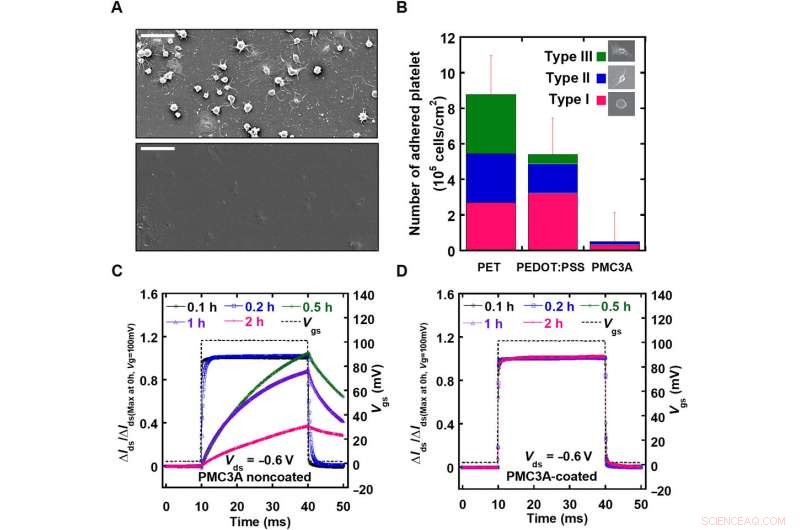
Evaluación de la compatibilidad sanguínea del recubrimiento de PMC3A en OECT. A) La imagen SEM de la película recubierta de polietileno tereftalato (PET) y PMC3A observada después de 1 hora de adhesión plaquetaria. B) El número medio de plaquetas adheridas en la película de PET en comparación con las películas de PEDOT:PSS y PMC3A después de 1 hora de adhesión de las plaquetas. C) Después de la adhesión de plaquetas con tiempos de adhesión de 0,1 a 2 horas, Los valores de τ de OECT con o sin recubrimiento de PMC3A se midieron aplicando un pulso de voltaje de puerta con una duración de 50 ms. D) La excelente compatibilidad con la sangre de la superficie permitió la monitorización de la señal de ECG a largo plazo. Crédito:Science Advances, doi:10.1126 / sciadv.aau2426
Luego, los investigadores llevaron a cabo estudios in vivo en un modelo de rata en el que se realizó la viabilidad de las matrices OECT hemocompatibles y estirables mediante mediciones de ECG en superficies cardíacas. Las señales fisiológicas se midieron utilizando la matriz de 4 x 4 de OECT elásticos y hemocompatibles uniéndolas a la superficie expuesta del corazón. Los orificios en forma de panal en el sustrato ultrafino permitieron un contacto conforme entre la película del dispositivo y la superficie del corazón.
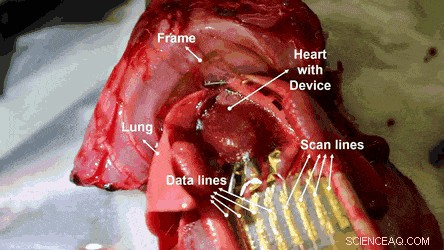
Mapeo electroanatómico en la superficie de un corazón usando MEA activo en el sustrato de rejilla de panal ultradelgado. Crédito:Science Advances, doi:10.1126 / sciadv.aau2426
La relación señal-ruido del OECT recubierto de PMC3A registrado a 51 dB 30 min después de la conexión fue similar al valor registrado justo después de la conexión. El orden de transconductancia de milisiemens observado en el estudio se debió a la permeabilidad al agua de PEDOT:PSS. Como resultado, la transconductancia de OECT fue 100 veces mayor que la de los transistores de efecto de campo de Si (FET).
Los investigadores también demostraron señales de mapeo de ECG utilizando la matriz OECT cuando el dispositivo se colocó en una superficie de corazón de rata que cubría las áreas del ventrículo izquierdo y derecho. La impedancia de carga fue diseñada para ser de 0 ohmios para suprimir sustancialmente la diafonía en la matriz OECT como se demostró anteriormente. Se visualizaron mapas de voltaje espacial de todos los nodos en cuatro puntos de tiempo secuenciales. Según la ubicación del sensor, las señales anatómicas mostraban diferentes formas. Las matrices OECT extensibles y compatibles con la sangre registraron con éxito la distribución espacio-temporal de los ECG en las superficies del corazón de ratas con multiplexación.
La cartografía electroanatómica sobre la superficie del corazón por multiplexación. Crédito:Science Advances, doi:10.1126 / sciadv.aau2426
En el estudio, Se logró una alta SNR de 52 dB debido a dos razones; primero, ya que los autores lograron utilizar OECT con alta transconductancia del orden de milisiemen. Mayor en un factor de 10 en comparación con el FET de Si monocristalino en presencia de hemorragia quirúrgica, mientras que el recubrimiento PMC3A mantuvo simultáneamente una alta conductividad iónica. Segundo, el ruido del artefacto de movimiento fue suprimido por la alta adaptabilidad de la arquitectura de la microrred:el dispositivo puede adherirse al objetivo dinámico durante el movimiento del corazón. Los MEA activos y estirables con recubrimiento PMC3A no trombogénico permitirán mediciones de ECG, Señales ECoG o EMG con mayor precisión en estudios preclínicos posteriores.
© 2018 Science X Network