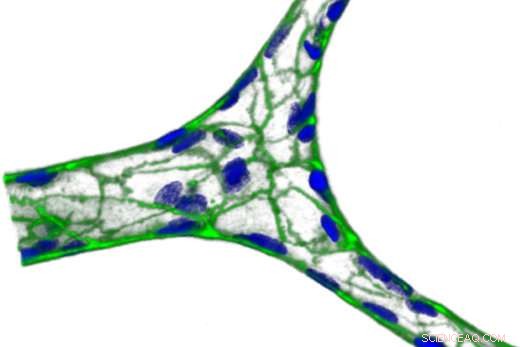
Un vaso sanguíneo en miniatura formado en hidrogel de agarosa / gelatina. El verde representa VE-cadherina, una proteína que une las células, y el azul es el núcleo. Crédito:Yongzhi Qiu
En enfermedades como la malaria y la anemia de células falciformes, los glóbulos rojos se descomponen, con efectos nocivos en el resto del cuerpo, particularmente en el revestimiento de los vasos sanguíneos pequeños.
Los ingenieros biomédicos han establecido un sistema modelo para estudiar estos problemas, que también tiene potencial para su uso en otras enfermedades cardiovasculares. El sistema construye una red de vasos sanguíneos artificiales, basado en materiales conocidos de "hidrogel" que se disuelven con el calor:gelatina y agarosa, un azúcar derivado de las algas.
Los resultados fueron publicados recientemente por Ingeniería Biomédica de la Naturaleza .
"La innovación tecnológica clave aquí es que nuestro hidrogel puede mantener estos recipientes creciendo durante semanas o meses, que es mucho más largo que los enfoques estándar, "dice el autor principal Wilbur Lam, MARYLAND, Doctor. "Con este sistema, podemos estudiar no sólo cómo los vasos responden a los aspectos de la enfermedad, sino también qué tan bien los vasos sanarán con el tiempo una vez que se eliminen esas agresiones ".
Lam es profesor asistente en el Departamento de Pediatría de la Facultad de Medicina de la Universidad de Emory y en el Departamento de Ingeniería Biomédica Wallace H. Coulter en Georgia Tech y Emory University.
Trabajando con Lam, instructor Yongzhi Qiu, Doctor. y sus colegas construyeron un dispositivo de microfluidos a base de hidrogel, con vasos ramificados de aproximadamente 20 micrómetros de ancho. Luego, el dispositivo puede recubrirse con células endoteliales, que recubren los vasos sanguíneos, y conectado a una bomba. Una ventaja de usar hidrogeles, los autores escriben, es que los hidrogeles no son tan rígidos como los polímeros sólidos, y así responder de una manera más fisiológicamente relevante a los cambios en el flujo de fluidos.
Una vez que esté completamente ensamblado, las células endoteliales debilitan sus barreras en respuesta a moléculas inflamatorias como el TNF-alfa y luego se curan.
Los investigadores también probaron las respuestas al hemo, un componente de la hemoglobina que se forma cuando los glóbulos rojos se abren, y probaron los efectos de los glóbulos rojos propensos a la oclusión de pacientes con anemia de células falciformes y los glóbulos rojos infectados por parásitos Plasmodium.
El sistema modelo podría usarse para analizar aún más los efectos de los glóbulos rojos frente a otras células y moléculas inflamatorias, y para detectar medicamentos que podrían prevenir daños en los vasos sanguíneos, dicen los investigadores.