Investigadores de la Universidad McMaster han descubierto características únicas de un mecanismo utilizado por las bacterias para resistir una clase importante de antibióticos. La nueva investigación, publicada en Nature Chemical Biology , muestra que la resistencia a los aminoglucósidos, utilizados para tratar una variedad de infecciones, es mucho más compleja de lo que se pensaba inicialmente.
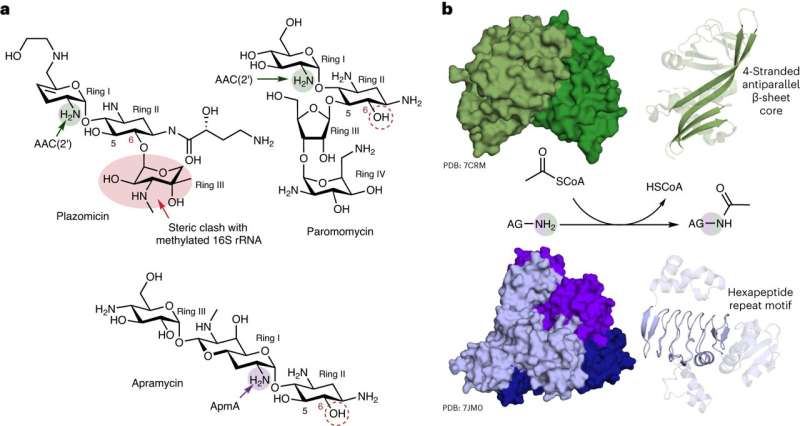
El investigador principal, Gerry Wright, profesor de Bioquímica y Ciencias Biomédicas en McMaster, dice que su laboratorio observó una versatilidad nunca antes vista en ApmA, un gen de resistencia bacteriana estudiado durante mucho tiempo. La investigación demostró que el gen puede permitir de manera inusual que las bacterias realicen diferentes funciones contra diferentes antibióticos.
De las cien o más enzimas de resistencia a los aminoglucósidos conocidas por los investigadores, Wright dice que sólo ésta ha mostrado un comportamiento tan ágil.
"Es un unicornio", dice. "Se ve diferente, funciona de manera diferente y pertenece a una familia de enzimas completamente diferente. Es completamente diferente de todos los mecanismos de resistencia que asociamos con esta clase de antibiótico".
Wright, miembro del Instituto Michael G. DeGroote para la Investigación de Enfermedades Infecciosas, dice que los aminoglucósidos estuvieron entre los primeros antibióticos con relevancia clínica y los primeros en ser útiles contra la tuberculosis. Pero como se recetan desde la década de 1940, dice que "la resistencia a ellos se ha convertido en un problema real", excepto en el caso de la apramicina.
"El antibiótico apramicina evita la mayoría de los mecanismos de resistencia, por lo que es un fuerte candidato para nuevas aplicaciones clínicas", afirma. "Desafortunadamente, este mecanismo que hemos estado estudiando no es uno que el fármaco pueda evitar".
Wright dice que el reciente descubrimiento de su laboratorio es importante porque la apramicina se encuentra actualmente en ensayos clínicos y, si se aprueba, tener una comprensión profunda de cómo las bacterias podrían resistir el fármaco será crucial para ampliar su utilidad.
"Si vamos a llevar este medicamento al mercado, entonces será mejor que sepamos cuál es el enemigo", afirma. "Aprender más sobre este mecanismo de resistencia único podría informar la investigación de seguimiento sobre la apramicina de próxima generación o los diagnósticos que podrían detectar ApmA en bacterias".
Más información: Emily Bordeleau et al, La plasticidad mecanística en ApmA permite la promiscuidad de aminoglucósidos para la resistencia, Nature Chemical Biology (2023). DOI:10.1038/s41589-023-01483-3
Información de la revista: Biología química de la naturaleza
Proporcionado por la Universidad McMaster