
Una ilustración combina dos posibles tipos de capas superficiales para un catalizador que realiza la reacción de división del agua, el primer paso en la fabricación de combustible de hidrógeno. La superficie gris cima, es óxido de lantano. La superficie colorida es óxido de níquel; una reordenación de sus átomos mientras se lleva a cabo la reacción la hizo dos veces más eficiente, un fenómeno que los investigadores esperan aprovechar para diseñar mejores catalizadores. Los átomos de lantano están representados en verde, níquel en azul y oxígeno en rojo. Crédito:Gráfico CUBE3D
Los científicos que elaboraron un catalizador a base de níquel utilizado para fabricar combustible de hidrógeno lo construyeron una capa atómica a la vez para obtener un control total sobre sus propiedades químicas. Pero el material terminado no se comportó como esperaban:a medida que una versión del catalizador realizaba su trabajo, la capa superior de átomos reorganizada para formar un nuevo patrón, como si las baldosas cuadradas que cubren un piso se hubieran transformado repentinamente en hexágonos.
Pero eso esta bien, informaron hoy, porque comprender y controlar esta sorprendente transformación les brinda una nueva forma de activar y desactivar la actividad catalítica y hacer que los buenos catalizadores sean aún mejores.
El equipo de investigación dirigido por científicos de la Universidad de Stanford y el Laboratorio Nacional Acelerador SLAC del Departamento de Energía, describió su estudio en Materiales de la naturaleza hoy dia.
"Los catalizadores pueden cambiar muy rápidamente durante el curso de una reacción, y comprender cómo se transforman de una fase inactiva a una activa es fundamental para diseñar catalizadores más eficientes, "dijo Will Chueh, investigador del Instituto de Ciencias de los Materiales y la Energía de Stanford (SIMES) en SLAC que dirigió el estudio. "Esta transformación nos da el equivalente a una perilla que podemos girar para ajustar su comportamiento".
División del agua para producir hidrógeno como combustible
Los catalizadores ayudan a las moléculas a reaccionar sin ser consumidas en la reacción, para que se puedan utilizar una y otra vez. Son la columna vertebral de muchos dispositivos de energía verde.
Este catalizador en particular, óxido de níquel lantano o LNO, se utiliza para dividir el agua en hidrógeno y oxígeno en una reacción alimentada por electricidad. Es el primer paso para generar combustible de hidrógeno, que tiene un enorme potencial para almacenar energía renovable de la luz solar y otras fuentes en forma líquida, rica en energía y fácil de transportar. De hecho, varios fabricantes ya han producido coches eléctricos propulsados por pilas de combustible de hidrógeno.
Pero este primer paso también es el más difícil, dijo Michal Bajdich, un teórico en el Centro SUNCAT de Ciencia de Interfaces y Catálisis en SLAC, y los investigadores han estado buscando materiales económicos que lo lleven a cabo de manera más eficiente.
Dado que las reacciones tienen lugar en la superficie de un catalizador, Los investigadores han estado tratando de diseñar con precisión esas superficies para que promuevan solo una reacción química específica con alta eficiencia.
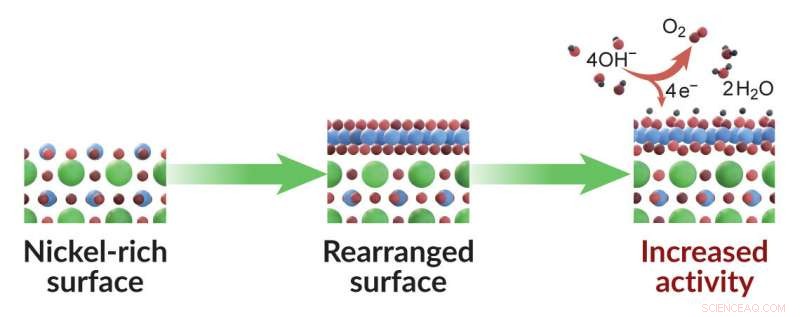
Un nuevo estudio muestra cómo ajustar la capa superficial de un catalizador puede hacer que funcione mejor. Este catalizador en particular se utiliza para dividir el agua, el primer paso en la fabricación de combustible de hidrógeno. Consiste en capas alternas de materiales ricos en níquel (esferas azules) y lantano (esferas verdes; las esferas rojas representan átomos de oxígeno). Cuando el material se cultiva a temperaturas relativamente frías de modo que una capa rica en níquel esté en la parte superior (izquierda), los átomos en esa capa superficial se reorganizan durante la reacción de división del agua (en el medio) de una manera que les permite llevar a cabo la reacción de manera más eficiente (derecha). Este sorprendente resultado ofrece a los científicos una nueva forma de ajustar la actividad catalítica y diseñar mejores catalizadores. Crédito:Tomas Duchon / Forschungszentrum Juelich
Materiales de construcción de una capa atómica a la vez
El LNO investigado en este estudio pertenece a una clase de materiales catalíticos prometedores conocidos como perovskitas, el nombre de un mineral natural con una estructura atómica similar.
Christoph Baeumer, que llegó a SLAC como becario Marie Curie de la Universidad de Aachen en Alemania para llevar a cabo el estudio, preparó LNO en lo que se conoce como una película delgada epitaxial, una película que crece en capas atómicamente delgadas de una manera que crea una disposición de átomos extraordinariamente precisa.
Dividiendo su tiempo entre California y Alemania, Baeumer hizo dos versiones de la película a diferentes temperaturas:una con una superficie rica en níquel y otra con una superficie rica en lantano. Luego, el equipo de investigación ejecutó todas las versiones a través de la reacción de división del agua para comparar qué tan bien se desempeñaron.
"Nos sorprendió descubrir que las películas con superficies ricas en níquel llevaban a cabo la reacción dos veces más rápido, "Dijo Baeumer.
Ajuste de la superficie de un catalizador para un mejor rendimiento
Para averiguar por qué el equipo llevó las películas al Laboratorio Nacional Lawrence Berkeley del DOE, donde un grupo dirigido por Slavomir Nemsak miró su estructura atómica con rayos X en la fuente de luz avanzada.
"Fue sorprendente que la diferencia entre el catalizador 'bueno' y el 'malo' estuviera solo en la última capa atómica de las películas, ", Dijo Nemsak. Esas investigaciones también revelaron que en películas con capas superficiales ricas en níquel que se prepararon a temperaturas más frías, la capa superior de átomos transformada en algún momento durante la reacción de división del agua, y esta nueva disposición impulsó la actividad catalítica.
Mientras tanto, Jiang Li, investigador postdoctoral y teórico en SUNCAT, realizó estudios computacionales de este sistema muy complejo utilizando el Centro Nacional de Computación Científica de Investigación Energética de Berkeley Lab (NERSC). Sus conclusiones coincidieron con los resultados experimentales, prediciendo que la versión del catalizador con la superficie transformada —de un patrón cúbico a uno hexagonal— sería la más activa y estable.
Bajdich dijo:"¿Es la transformación de la superficie rica en níquel impulsada por la forma en que se prepara el catalizador, ¿O por los cambios que sufre mientras lleva a cabo la reacción de desdoblamiento del agua? Eso es muy difícil de responder. Parece que ambos tienen que ocurrir ".
Aunque este catalizador en particular no es el mejor del mundo para dividir el agua en hidrógeno y oxígeno, él dijo, descubrir cómo la transformación de una superficie aumenta su actividad es importante y podría aplicarse también a otros materiales.
"Si podemos descubrir los secretos de esta transformación para poder ajustarla con precisión, " él dijo, "Entonces podemos aprovechar este fenómeno para hacer catalizadores mucho mejores en el futuro".