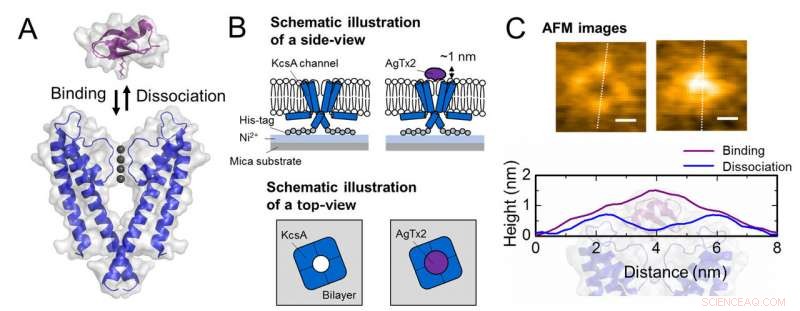
Esquema de asociación y disociación del canal de potasio KcsA (Q58A / T61S / R64D) y AgTx2 e imágenes AFM representativas. A. Asociación (unión) de KcsA y AgTx2. B. Esquema que muestra una muestra para observación AFM.
C. Imágenes AFM representativas y con dimensiones mostradas como líneas punteadas blancas. Bar, 2 nm. Crédito:Universidad de Kanazawa
La agitoxina-2 (AgTx2) del veneno de escorpión es un potente bloqueador de los canales de K +. Los investigadores ahora han observado la dinámica de unión de AgTx2 al canal KcsA utilizando microscopía de fuerza atómica de alta velocidad. Los análisis cinéticos de una sola molécula revelaron que la afinidad del canal por AgTx2 aumentó durante la unión persistente y disminuyó durante la disociación persistente. Los investigadores proponen un modelo de cuatro estados con constantes de velocidad relevantes. Una vía de ajuste inducido fue dominante y aceleró la unión 400 veces.
Las membranas celulares contienen canales iónicos que regulan la penetración de varios iones entre el interior y el exterior de la célula. Los canales de iones son proteínas, y en respuesta a diversos estímulos, permiten que penetren iones específicos. De esta forma la célula regula las señales eléctricas que forman la base de la función de los músculos y el sistema nervioso. Dado que un mal funcionamiento de los canales iónicos causa una serie de trastornos como infarto de miocardio y epilepsia, Es importante comprender el mecanismo de acción de las moléculas que obstaculizan las funciones de los canales iónicos.
Se ha descubierto que el veneno de escorpión contiene más de 200 compuestos que se unen a los canales de K +. Entre ellos, AgTx2 es un péptido que consta de 38 residuos de aminoácidos. Estudios anteriores demostraron que al unirse al canal de K + desde el exterior de la membrana celular, AgTx2 bloquea el poro del canal de K + e inhibe la permeación de K +. Sin embargo, el mecanismo molecular detallado seguía siendo desconocido, p.ej. si la dinámica de unión podría explicarse mediante un modelo de asociación y disociación de dos estados.
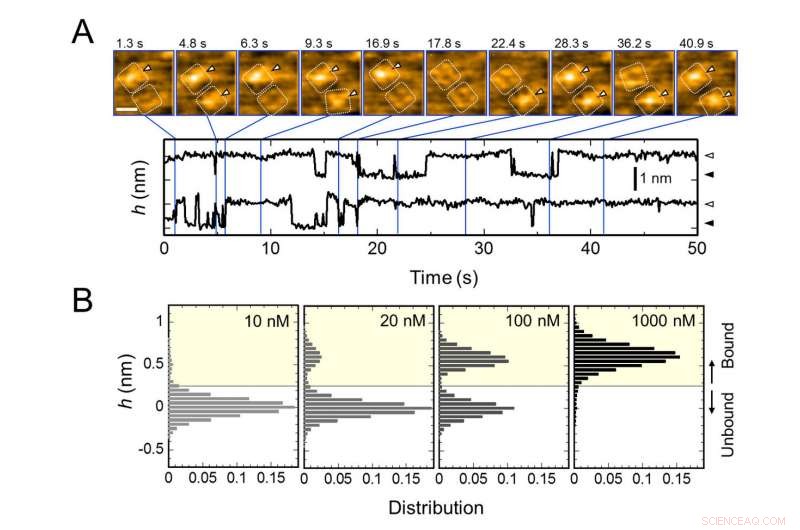
Unión repetitiva de AgTx2 al canal de potasio KcsA y AgTx2 - dependencia de la concentración de la probabilidad de unión. A. Imágenes de lapso de tiempo de la unión de AgTx2 y disociación de los canales de KcsA y cursos de tiempo de la altura promedio (h) (nm) alrededor del centro de la superficie extracelular. Barra de escala en la imagen HS-AFM, 5 nm. B. Histogramas de altura de h dependiendo de la concentración de AgTx2 en la solución. Crédito:Universidad de Kanazawa
El equipo de investigación incluidos científicos de la Universidad de Kanazawa, visualizaron la asociación y disociación de AgTx2 con el canal de K + KcsA utilizando microscopía de fuerza atómica de alta velocidad (HS-AFM) y realizaron un análisis detallado de la dinámica (Figura 1). KcsA es un tetrámero, sus subunidades forman una estructura en forma de anillo. Tras la unión de AgTx2 a la superficie del tetrámero, la parte central del canal, es decir, el pasaje para K +, parecía hinchado debido a la unión de AgTx2. La unión y disociación de AgTx2 al canal de K + podría tener lugar repetidamente y la altura alrededor del centro del canal cambió en consecuencia (Figura 2).
Cuando la concentración de AgTx2 en la solución era alta, la probabilidad de vinculación también fue alta. Los cursos de tiempo de la unión y disociación revelaron que tras la unión de AgTx2 a KcsA, la conformación de KcsA cambió, lo que permitió la unión de AgTx2 más fácilmente, y que incluso tras la disociación de AgTx2, otra molécula de AgTx2 podría unirse a KcsA muy rápidamente; esto se conoce como mecanismo de ajuste inducido. Por otra parte, se observó que, cuando haya transcurrido suficiente tiempo después de la disociación de AgTx2, la conformación de KcsA cambió de nuevo a la original, al cual AgTx2 se unió con menos facilidad.
Estos resultados indican que la dinámica de vinculación no se puede explicar con un modelo simple de dos estados, es decir, unión y disociación. Parecía que tanto los estados de asociación como los de disociación de KcsA podían distinguirse como al menos dos subestados; Por lo tanto, se consideró un modelo de asociación de cuatro estados (Figura 3). Cuando se calcularon las velocidades de reacción para un modelo de cuatro estados, las velocidades obtenidas reflejaron las obtenidas experimentalmente. Una simulación de la dinámica de unión con este modelo de cuatro estados y las velocidades de reacción asociadas, mostró que la unión de AgTx2 es principalmente a través de la vía de ajuste inducido. Más lejos, Se encontró que el ajuste inducido aceleraba la unión de AgTx2 en 400 veces. Por lo tanto, Se ha dilucidado el mecanismo de AgTx2 para inhibir eficazmente la función de KcsA (Figura 3).
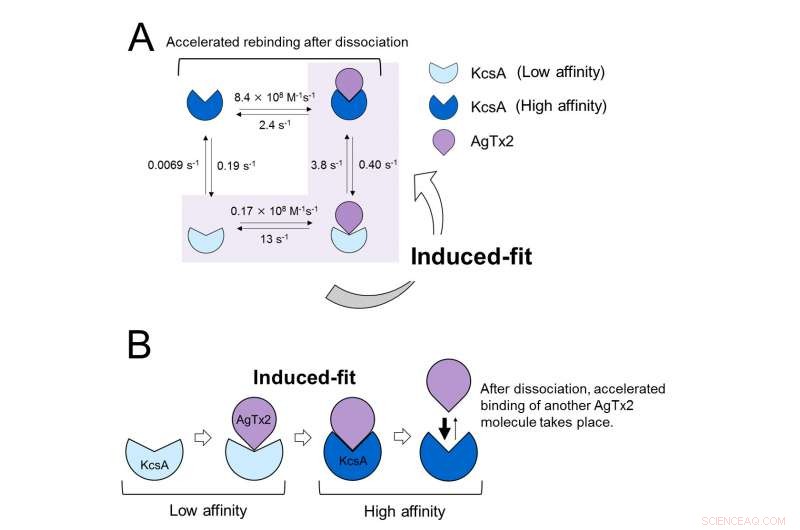
Modelo de dinámica de unión de AgTx2 y canal de potasio KcsA. A. Tasas constantes de los pasos de reacción. B. Unión acelerada de AgTx2 al canal de potasio KcsA a través del mecanismo de ajuste inducido. Crédito:Universidad de Kanazawa
La técnica y el método de observación de HS-AFM utilizados para el análisis de la unión del canal de K + y el inhibidor peptídico se pueden aplicar a una amplia variedad de moléculas biológicas. Se pueden aplicar a los análisis de un ligando que se une a su receptor, así como a la asociación de ADN y una proteína de unión al ADN. Se espera que este estudio acelere la elucidación de la dinámica de unión de varias moléculas biológicas.
El estudio se publica en Avances de la ciencia .