El virus de Lassa (LASV) es el patógeno que causa la fiebre hemorrágica de Lassa, una enfermedad endémica de África occidental, que causa aproximadamente 5.000 muertes cada año. En el Centro CSSB de Biología de Sistemas Estructurales, los grupos de Uetrecht (CSSB, LIV, Uni Siegen), Kosinski (CSSB, EMBL) y Rosenthal (BNITM, CSSB) trabajaron juntos para revelar el papel crucial desempeñado por el ARN en pasos críticos del proceso de Lassa. ciclo de vida del virus.
Sus hallazgos se publican en el Journal of the American Chemical Society. .
En el cuerpo humano, 20.000 genes producen más de un millón de formas diferentes de proteínas. En comparación, el virus Lassa es minúsculo ya que está compuesto por sólo cuatro proteínas, conocidas como L, NP, Z y GPC.
"Estamos tratando de comprender cómo estas cuatro proteínas pueden causar daños tan graves a las células humanas", explica el primer autor del artículo, Lennart Sänger. "Las actividades y la expresión de estas proteínas deben estar estrictamente reguladas y las proteínas deben comunicarse eficientemente entre sí para asumir diferentes funciones".
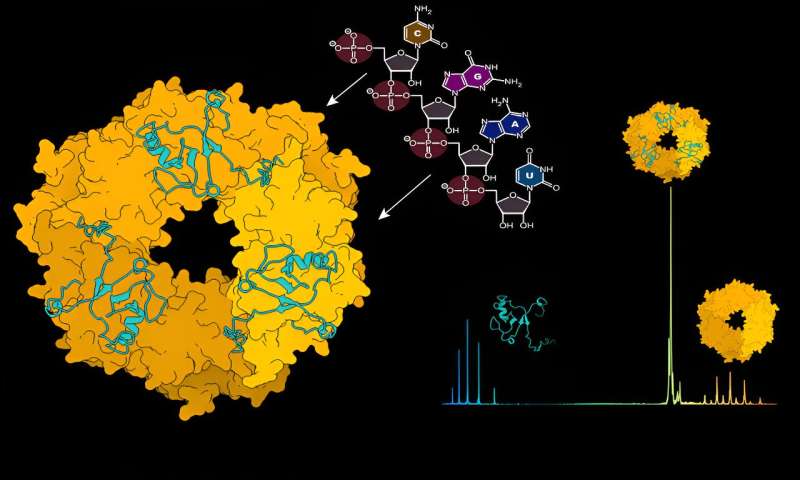
Para proteger y ocultar el virus de la detección por parte del sistema inmunológico, la nucleoproteína (NP) encierra el genoma viral en una cápside. Esta cápside junto con el ARN viral y la proteína L forman complejos de ribonucleoproteínas (RNP).
Para propagar la infección, las RNP deben reestructurarse continuamente para permitir la replicación y transcripción del genoma viral. Los investigadores estudiaron las interacciones entre NP y el ARN viral, así como la proteína Z, para comprender mejor el mecanismo y la dinámica de la formación y empaquetado de RNP en nuevas partículas virales.
Utilizando espectrometría de masas estructural, un método que actúa como una escala molecular al revelar el peso atómico de las interacciones moleculares, los investigadores examinaron la dinámica entre la NP y el ARN viral. "Al principio, la proteína NP no existe en una composición que pueda unirse al ARN viral", explica Charlotte Uetrecht, líder del grupo CSSB y experta en técnicas de espectrometría de masas.
"Es necesario que se produzca un cambio para permitir esta unión y descubrimos que el ARN viral puede iniciar este cambio por sí solo". Los investigadores identificaron el ARN como el motor para el desmontaje de los trímeros de NP en forma de anillo en monómeros que luego pueden formar conjuntos de NP unidos a ARN de orden superior.
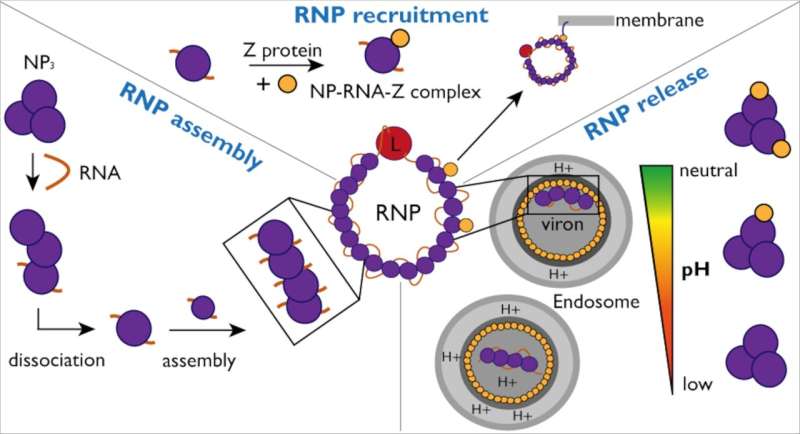
Los investigadores también investigaron con más detalle la interacción de NP con la proteína Z. Para facilitar esto, el grupo de Kosinski utilizó AlphaFold para predecir el sitio de interacción del complejo NP-Z. Estas predicciones fueron luego verificadas por investigadores en el laboratorio.
"El uso de la inteligencia artificial nos permitió identificar rápidamente posibles interacciones y también crear mutantes para verificar nuestra hipótesis", señala Jan Kosinski. Finalmente, los investigadores pudieron demostrar que, si bien la NP se une a Z independientemente de la presencia de ARN, esta interacción depende del pH.
"En general, estos hallazgos ayudan a mejorar nuestra comprensión del ensamblaje, reclutamiento y liberación de RNP en el virus Lassa", explica Maria Rosenthal, experta en virus Lassa en el Instituto Bernhard Nocht de Medicina Tropical y miembro asociado del CSSB. En África Occidental, se prevé que 186 millones de personas estarán en riesgo de infección por el virus Lassa para 2030, y la Organización Mundial de la Salud reconoce que el virus Lassa es un patógeno peligroso pero aún poco estudiado.
"Comprender cómo funciona el virus de Lassa puede, en última instancia, permitirnos desarrollar moléculas que podrían inhibir la replicación de este virus y tratar la fiebre de Lassa", señala Rosenthal.
Más información: Lennart Sänger et al, ARN para gobernarlos a todos:pasos críticos en el ensamblaje y reclutamiento de ribonucleopartículas del virus de Lassa, Revista de la Sociedad Química Estadounidense (2023). DOI:10.1021/jacs.3c07325
Información de la revista: Revista de la Sociedad Química Estadounidense
Proporcionado por el Centro CSSB de Biología de Sistemas Estructurales