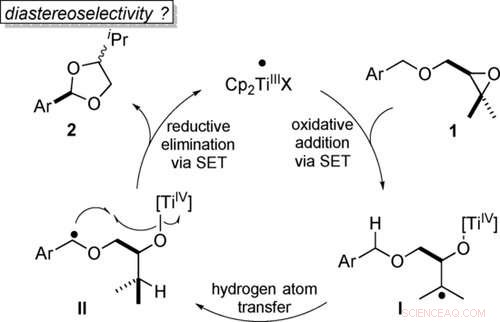
Transformación átomo-económica de éteres bencílicos en acetales mediante catálisis de titanoceno (III) en pasos de un solo electrón (SET). Angewandte Chemie, DOI:10.1002 / anie.202013561
Los acetales son compuestos químicos importantes que se utilizan, por ejemplo, en la producción de ciertos agentes médicos. Un nuevo método ahora hace que su síntesis sea más fácil y más respetuosa con el medio ambiente. Los químicos de la Universidad de Bonn han desarrollado y optimizado el proceso catalítico sostenible. También se utilizaron simulaciones por ordenador de última generación. La reacción se basa en un mecanismo que ocurre con frecuencia en la naturaleza, pero rara vez se ha utilizado en síntesis química hasta ahora. Los resultados se publican en la revista Angewandte Chemie .
El paso clave en la producción de acetales es la unión de dos átomos de oxígeno a un átomo de carbono. Los químicos a menudo logran este arreglo con oxidación. Normalmente se utilizan agentes oxidantes fuertes para lograr esto liberando un átomo de oxígeno durante la reacción. El resto del oxidante debe eliminarse después de la síntesis.
"En nuestro estudio, sin embargo, describimos un camino que se conoce como atómico-económico, es decir, que no genera residuos, "explica el Prof. Dr. Andreas Gansäuer del Instituto Kekulé de Química Orgánica y Bioquímica de la Universidad de Bonn." La molécula de partida ya contiene el átomo de oxígeno necesario para la oxidación. La catálisis que hemos desarrollado simplemente desplaza este oxígeno en la molécula, que crea el acetal ".
La molécula de partida contiene un grupo llamado epoxi, una especie de "triángulo" en el que dos esquinas están formadas por átomos de carbono y la tercera por un átomo de oxígeno. Estos anillos triples están sometidos a una gran tensión y, por lo tanto, se rompen fácilmente en el átomo de oxígeno. Los epóxicos almacenan la energía de reacción necesaria como un resorte comprimido.
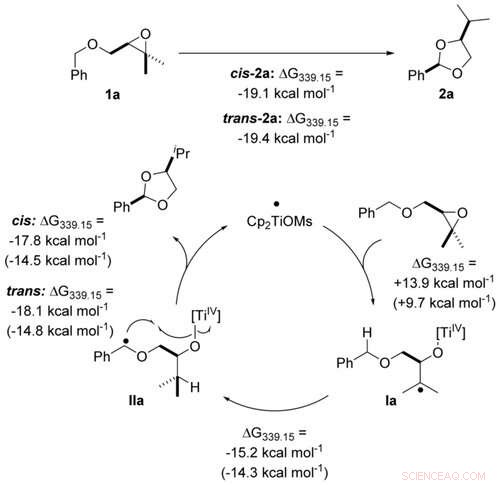
Transformación átomo-económica de éteres bencílicos en acetales mediante catálisis de titanoceno (III) en pasos de un solo electrón calculados al nivel PW6B95 ‐ D4 / def2 ‐ QZVP + COSMO ‐ RS (THF) // PBEh ‐ 3c / DCOSMO ‐ RS (THF). Los valores entre paréntesis se calculan para el catalizador Cp2TiCl. Angewandte Chemie, DOI:10.1002 / anie.202013561
Catálisis basada en el modelo de la naturaleza
Para lograr este objetivo se requiere un catalizador adecuado. Hablando en sentido figurado, Los átomos de oxígeno tienen dos "brazos" con los que pueden formar enlaces. Si el anillo de epoxi se rompe, uno de estos brazos queda libre. El catalizador ahora se une a él temporalmente. Esto inicia una secuencia de reordenamientos internos de moléculas (intramoleculares). Al final de esta secuencia, el átomo de oxígeno libera el catalizador nuevamente y en su lugar se une al carbono deseado. "Este paso se llama rebote de oxígeno, "dice Gansäuer.
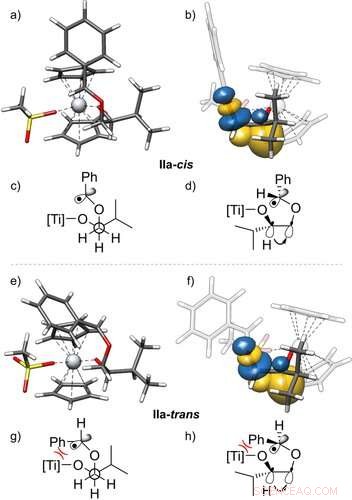
Estructuras 3D de los radicales IIa ‐ cis (a, b) y IIa ‐ trans (e, f) y su estabilización por interacciones torpes, con vista lateral. Los orbitales de enlace natural (NBO) 23 que se muestran se obtienen de un cálculo de PBEh ‐ 3c + CPCM (THF). Además, las proyecciones de Newman (c, g) y estructuras de cuñas y guiones (d, h) de estos radicales se dan. Muestran el orbital del enlace C-H donándose al orbital σ * del enlace C-O, visualizando el efecto gauche. Solo se muestra una de las dos interacciones gauche efectivas. Valor de isosuperficie =0.05 e − 1/2 bohr − 3/2. Angewandte Chemie, DOI:10.1002 / anie.202013561
Este mecanismo rara vez se ha utilizado en síntesis químicas hasta la fecha, muy diferente en la naturaleza:el hígado, por ejemplo, utiliza el "rebote de oxígeno" para descomponer las toxinas. Esto también requiere catalizadores, las llamadas enzimas P450. Su centro activo contiene un átomo de hierro. "El corazón de nuestro catalizador también consiste en un metal común y no tóxico, a saber, titanio, "explica el Prof. Dr. Stefan Grimme del Instituto de Química Física y Teórica de la Universidad de Bonn.
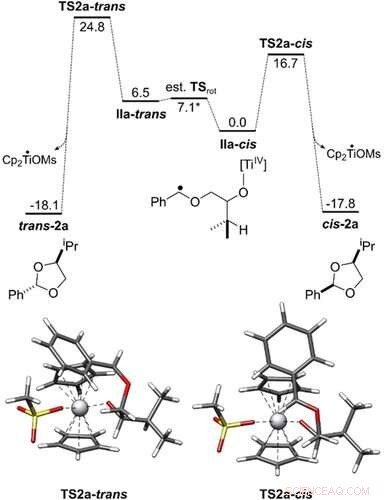
Perfil energético de la conversión de IIa ‐ cis y IIa ‐ trans en cis ‐ 2 a y trans ‐ 2 a. Todas las energías libres de Gibbs se muestran en kcal mol − 1. Las geometrías del estado de transición se obtuvieron con PBEh ‐ 3c / COSMO (THF). El ciclo catalítico se ha investigado al nivel teórico PW6B95 ‐ D4 / def2 ‐ QZVP + COSMO ‐ RS (THF) // PBEh ‐ 3c / COSMO (THF). Angewandte Chemie, DOI:10.1002 / anie.202013561
Sintonización de catalizador en la computadora
Durante la síntesis de acetal, El titanio absorbe primero un átomo de oxígeno y luego lo libera de nuevo (la oxidación va seguida de la denominada reducción). Esto sólo funciona eficazmente si une el oxígeno con la suficiente fuerza a sí mismo sin "adherirse" demasiado. Para ajustar adecuadamente su afinidad por el oxígeno, el titanio está unido a ciertas moléculas, sus ligandos. Dependiendo del socio vinculante, el metal tiene entonces un efecto oxidante algo más fuerte o puede reducirse más fácilmente. En la actualidad, las "moléculas de sintonización" más adecuadas se seleccionan con la ayuda de un ordenador. El grupo de investigación en torno al profesor Grimme se especializa en esta tarea:En los últimos años, ha desarrollado algoritmos que permiten simulaciones muy rápidas de las propiedades del catalizador.
Esto permitió a los investigadores en su estudio optimizar su catalizador para que convierta completamente el material de partida en el acetal deseado. "El resultado documenta muy bien lo útil que es la estrecha cooperación entre el experimento y la teoría para desarrollar métodos de catálisis sostenibles, "dice Gansäuer.