Una reacción química clave, en la que el movimiento de protones entre la superficie de un electrodo y un electrolito impulsa una corriente eléctrica, es un paso crítico en muchas tecnologías energéticas, incluidas las pilas de combustible y los electrolizadores utilizados para producir gas hidrógeno.
Por primera vez, químicos del MIT han mapeado en detalle cómo ocurren estas transferencias de electrones acoplados a protones en la superficie de un electrodo. Sus resultados podrían ayudar a los investigadores a diseñar pilas de combustible, baterías u otras tecnologías energéticas más eficientes.
El artículo de investigación se publica en la revista Nature Chemistry. .
"Nuestro avance en este artículo fue estudiar y comprender la naturaleza de cómo estos electrones y protones se acoplan en un sitio de superficie, lo cual es relevante para reacciones catalíticas que son importantes en el contexto de dispositivos de conversión de energía o reacciones catalíticas", dice Yogesh Surendranath, un profesor de química e ingeniería química en el MIT y autor principal del estudio.
Entre sus hallazgos, los investigadores pudieron rastrear exactamente cómo los cambios en el pH de la solución electrolítica que rodea un electrodo afectan la velocidad del movimiento de los protones y el flujo de electrones dentro del electrodo.
El estudiante graduado del MIT Noah Lewis es el autor principal del artículo. Ryan Bisbey, ex postdoctorado del MIT; Karl Westendorff, estudiante de posgrado del MIT; y Alexander Soudackov, científico investigador de la Universidad de Yale, también son autores del artículo.
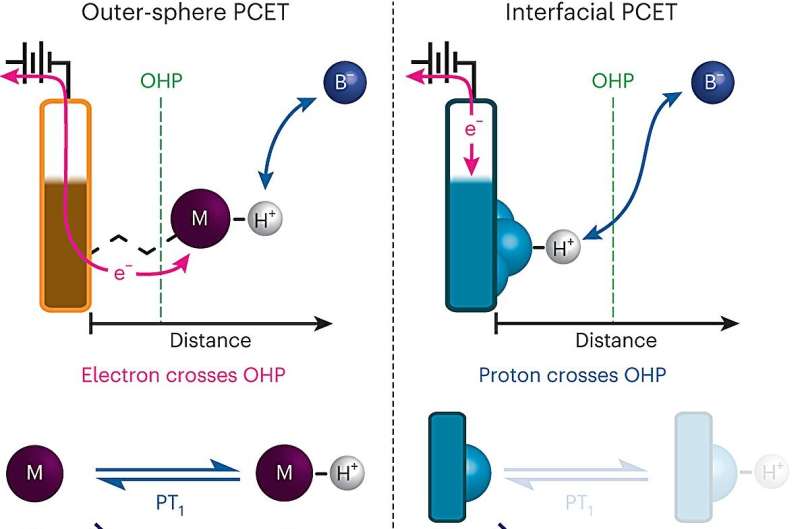
La transferencia de electrones acoplados a protones ocurre cuando una molécula, a menudo agua o un ácido, transfiere un protón a otra molécula o a la superficie de un electrodo, lo que estimula al aceptor de protones para que también tome un electrón. Este tipo de reacción se ha aprovechado para muchas aplicaciones energéticas.
"Estas reacciones de transferencia de electrones acoplados a protones son omnipresentes. A menudo son pasos clave en los mecanismos catalíticos y son particularmente importantes para los procesos de conversión de energía, como la generación de hidrógeno o la catálisis de pilas de combustible", dice Surendranath.
En un electrolizador generador de hidrógeno, este enfoque se utiliza para eliminar protones del agua y agregar electrones a los protones para formar gas hidrógeno. En una pila de combustible, la electricidad se genera cuando se eliminan protones y electrones del gas hidrógeno y se añaden al oxígeno para formar agua.
La transferencia de electrones acoplados a protones es común en muchos otros tipos de reacciones químicas; por ejemplo, la reducción de dióxido de carbono (la conversión de dióxido de carbono en combustibles químicos mediante la adición de electrones y protones). Los científicos han aprendido mucho sobre cómo ocurren estas reacciones cuando los aceptores de protones son moléculas, porque pueden controlar con precisión la estructura de cada molécula y observar cómo pasan electrones y protones entre ellas.
Sin embargo, cuando la transferencia de electrones acoplados a protones ocurre en la superficie de un electrodo, el proceso es mucho más difícil de estudiar porque las superficies de los electrodos suelen ser muy heterogéneas, con muchos sitios diferentes a los que potencialmente podría unirse un protón.
Para superar ese obstáculo, el equipo del MIT desarrolló una forma de diseñar superficies de electrodos que les brinda un control mucho más preciso sobre la composición de la superficie del electrodo. Sus electrodos consisten en láminas de grafeno con compuestos orgánicos que contienen anillos adheridos a la superficie. Al final de cada una de estas moléculas orgánicas hay un ion de oxígeno cargado negativamente que puede aceptar protones de la solución circundante, lo que hace que un electrón fluya desde el circuito hacia la superficie de grafito.
"Podemos crear un electrodo que no consista en una amplia diversidad de sitios, sino que sea una matriz uniforme de un solo tipo de sitios muy bien definidos, cada uno de los cuales puede unirse a un protón con la misma afinidad", dice Surendranath. "Dado que tenemos estos sitios muy bien definidos, lo que esto nos permitió hacer fue realmente desentrañar la cinética de estos procesos".
Usando este sistema, los investigadores pudieron medir el flujo de corriente eléctrica a los electrodos, lo que les permitió calcular la tasa de transferencia de protones al ion oxígeno en la superficie en equilibrio, el estado en el que las tasas de donación de protones a la superficie y la transferencia de protones de regreso a la solución desde la superficie son iguales. Descubrieron que el pH de la solución circundante tiene un efecto significativo en esta tasa:las tasas más altas se produjeron en los extremos de la escala de pH:pH 0, el más ácido, y pH 14, el más básico.
Para explicar estos resultados, los investigadores desarrollaron un modelo basado en dos posibles reacciones que pueden ocurrir en el electrodo. En el primero, los iones hidronio (H 3 O + ), que se encuentran en alta concentración en soluciones fuertemente ácidas, liberan protones a la superficie de iones de oxígeno, generando agua. En el segundo, el agua entrega protones a los iones de oxígeno de la superficie, generando iones de hidróxido (OH - ), que se encuentran en alta concentración en soluciones fuertemente básicas.
Sin embargo, la velocidad a pH 0 es aproximadamente cuatro veces más rápida que la velocidad a pH 14, en parte porque el hidronio cede protones a una velocidad más rápida que el agua.
Los investigadores también descubrieron, para su sorpresa, que las dos reacciones tienen velocidades iguales, no a pH neutro 7, donde las concentraciones de hidronio e hidróxido son iguales, sino a pH 10, donde la concentración de iones de hidróxido es 1 millón de veces mayor que la del hidronio. El modelo sugiere que esto se debe a que la reacción directa que implica la donación de protones del hidronio o el agua contribuye más a la velocidad general que la reacción inversa que implica la eliminación de protones por el agua o el hidróxido.
Los modelos existentes de cómo ocurren estas reacciones en las superficies de los electrodos suponen que las reacciones hacia adelante y hacia atrás contribuyen por igual a la velocidad general, por lo que los nuevos hallazgos sugieren que es posible que sea necesario reconsiderar esos modelos, dicen los investigadores.
"Ésa es la suposición predeterminada:que las reacciones directa e inversa contribuyen por igual a la velocidad de reacción", dice Surendranath. "Nuestro hallazgo es realmente revelador porque significa que la suposición que la gente utiliza para analizar todo, desde la catálisis de las pilas de combustible hasta la evolución del hidrógeno, puede ser algo que debamos revisar".
Los investigadores ahora están usando su configuración experimental para estudiar cómo agregar diferentes tipos de iones a la solución electrolítica que rodea el electrodo puede acelerar o disminuir la velocidad del flujo de electrones acoplados a protones.
"Con nuestro sistema, sabemos que nuestros sitios son constantes y no se afectan entre sí, por lo que podemos leer qué efecto tiene el cambio en la solución en la reacción en la superficie", dice Lewis.
Más información: Noah B. Lewis et al, Un marco mecanicista a nivel molecular para la cinética de transferencia de electrones interfacial acoplada a protones, Nature Chemistry (2024). DOI:10.1038/s41557-023-01400-0
Información de la revista: Química de la naturaleza
Proporcionado por el Instituto de Tecnología de Massachusetts
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre investigación, innovación y enseñanza del MIT.