Paclitaxel es el fármaco anticancerígeno de origen vegetal más vendido en el mundo y uno de los fármacos anticancerígenos más eficaces de los últimos 30 años. Se utiliza ampliamente en el tratamiento de varios tipos de cáncer, incluidos el cáncer de mama, el cáncer de pulmón y el cáncer de ovario.
A finales de la década de 1990 y principios del siglo XXI, las ventas anuales de paclitaxel superaron los 1.500 millones de dólares y alcanzaron los 2.000 millones de dólares en 2001, lo que lo convirtió en el fármaco más vendido en 2001. En 2019, el mercado de paclitaxel y sus derivados era de aproximadamente 15.000 millones de dólares, y se espera que alcance los 20 mil millones de dólares en 2025.
Como fármaco anticancerígeno, la estructura molecular del paclitaxel es extremadamente compleja, con anillos con puentes intrincados y altamente oxidados y 11 estereocentros, lo que lo reconoce ampliamente como uno de los productos naturales más difíciles de sintetizar químicamente. Desde que los grupos de investigación Holton y Nicolaou informaron sobre la primera síntesis total de paclitaxel en 1994, más de 40 equipos de investigación han participado en la síntesis total de paclitaxel.
Sin embargo, incluso en la ruta de síntesis química más corta hasta la fecha, el rendimiento global de paclitaxel es de sólo el 0,118%, lo que no alcanza para satisfacer la demanda de producción industrial. Actualmente, la producción industrial de paclitaxel emplea una estrategia semisintética:aislar precursores de paclitaxel (como la baccatina III) de cultivos de células vegetales u hojas de Taxus y luego convertirlos en paclitaxel mediante métodos químicos. Sin embargo, la estrategia semisintética depende en gran medida de los recursos naturales y está limitada por el lento crecimiento de las células u hojas de Taxus y, por lo tanto, no puede satisfacer la creciente demanda del mercado.
Con el rápido desarrollo de la biotecnología, las estrategias de biología sintética para la biosíntesis microbiana de productos naturales vegetales han surgido como un enfoque poderoso para producir productos naturales vegetales complejos de manera eficiente.
Por lo tanto, lograr una producción eficiente, respetuosa con el medio ambiente y sostenible de paclitaxel mediante biología sintética ha atraído una atención generalizada. Sin embargo, realizar la síntesis de novo de paclitaxel en un sistema heterólogo requiere identificar las enzimas clave que faltan en la ruta biosintética de paclitaxel y establecer una ruta biosintética completa para paclitaxel.
Para abordar el desafío de larga data de la biosíntesis de paclitaxel en Taxus, dos equipos de investigación dirigidos por el Prof. Jianbin Yan (Instituto de Genómica Agrícola de Shenzhen, AGIS) y el Prof. Xiaoguang Lei (Universidad de Pekín, PKU), así como otros equipos de investigación de Otras cinco instituciones diferentes, incluidas la Universidad de Tsinghua y la UCLA, han colaborado juntas para identificar con éxito las enzimas faltantes y lograr la reconstitución de las enzimas biosintéticas que conducen a la bacatina III.
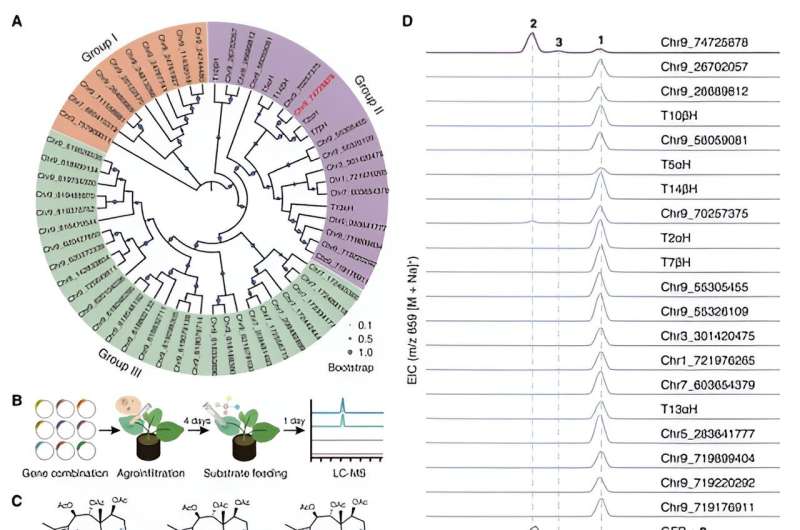
Los investigadores utilizaron un sistema de expresión heteróloga del tabaco para realizar la detección de la actividad de la familia de genes CYP725A que se encuentra específicamente en Taxus mediante una estrategia de coinyección de sustrato. Han identificado con éxito una enzima biosintética llamada taxano oxetanasa (TOT) que cataliza la formación del anillo de oxetano durante la vía de biosíntesis del taxol.
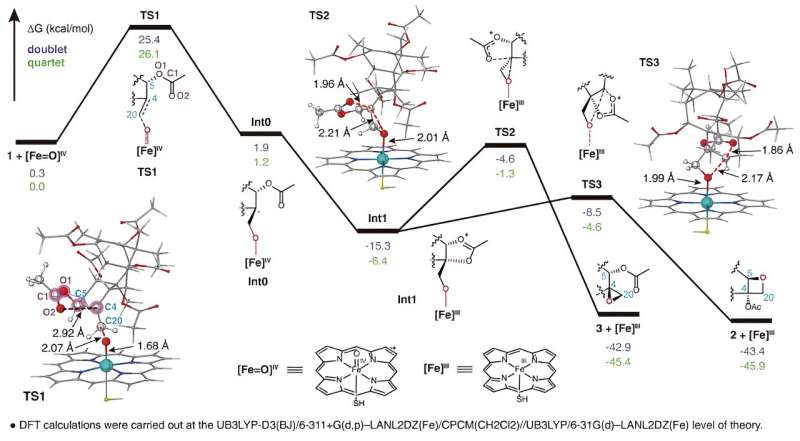
TOT cataliza la formación del anillo de oxetano único mediante la oxidación del doble enlace C4,20 y la posterior reordenación del grupo acetilo adyacente en la posición C5, como se muestra en. Este novedoso mecanismo de reacción de formación del anillo de oxetano rompe la comprensión convencional de que el anillo de oxetano La formación en la ruta de biosíntesis del taxol se logra mediante una reacción de reordenamiento del epóxido correspondiente.
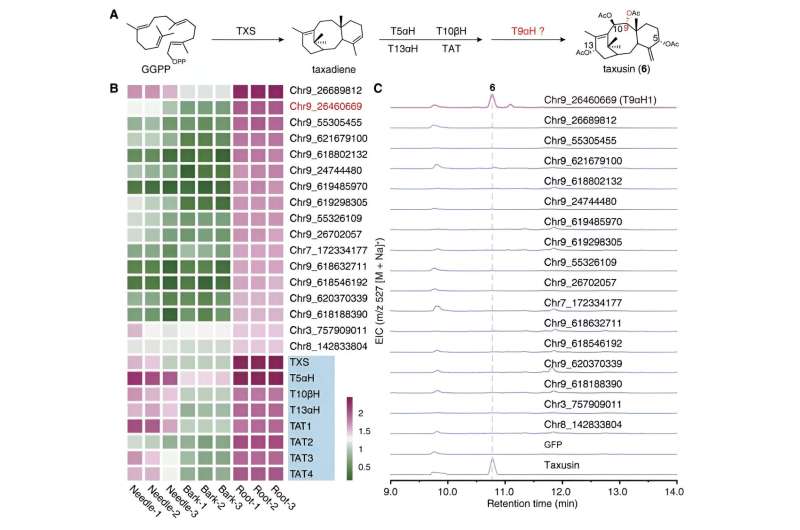
Mientras tanto, centrándose en el compuesto estructuralmente más simple, la taxusina, los investigadores identificaron 17 genes candidatos que codifican enzimas responsables de la oxidación C9 de los taxanos mediante el análisis de coexpresión y el análisis del metabolismo. Estos genes candidatos se sometieron además a un análisis de actividad mediante la reconstrucción de la ruta biosintética de la taxusina en el tabaco, lo que llevó al descubrimiento de la enzima responsable de la oxidación de C9 en los taxanos, que se denominó Taxano 9α hidroxilasa (T9αH).
Con estas dos enzimas TOT y T9αH recientemente identificadas en sus manos, los investigadores intentaron lograr la biosíntesis total de bacatina III en el tabaco coexpresándolas con otros genes biosintéticos conocidos del taxol. Detectaron con éxito la producción de bacatina III en el tabaco cuando TOT y T9αH se coexpresaron con otros siete genes biosintéticos conocidos (TXS, T5αH, T13αH, T2αH, T7βH, TAT y TBT). Además, han demostrado que estos nueve genes son los genes centrales para la biosíntesis de baccatin III, ya que cada gen es indispensable para la biosíntesis de baccatin III en el tabaco.
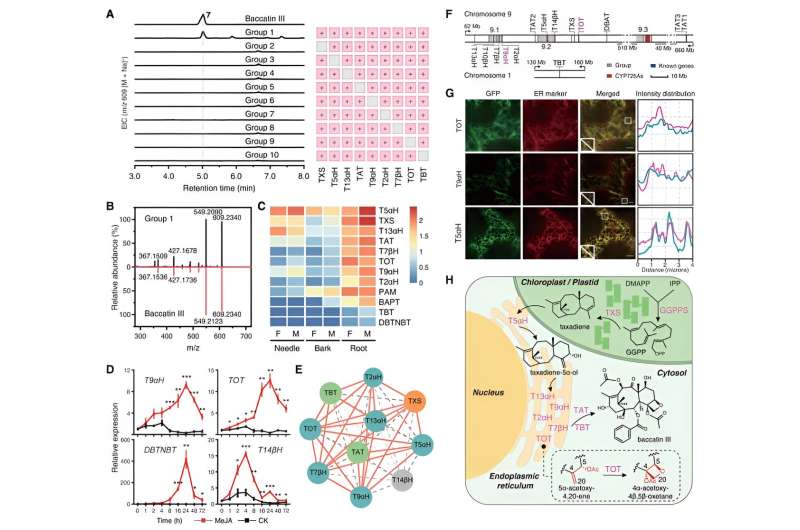
Otros estudios bioquímicos demostraron que estos genes centrales exhiben una estrecha sinergia funcional y están coregulados por la hormona vegetal jasmonato, lo que demuestra patrones de expresión de inducción similares y una fuerte correlación de expresión. Al combinar el análisis de localización subcelular y otros resultados experimentales, los investigadores proporcionan una descripción completa del proceso biosintético de la bacatina III.
El sustrato inicial GGPP es catalizado por TXS para formar taxadieno en los cloroplastos. Posteriormente, el taxadieno se transfiere al citoplasma a través de los sitios de contacto entre el plastidio y el retículo endoplásmico y sufre una catálisis concertada mediante seis oxidasas unidas a la membrana (T2αH, T5αH, T7βH, T9αH, T13αH y TOT) ancladas en el retículo endoplásmico y dos acilos citoplasmáticos. transferasas (TAT y TBT), lo que finalmente resulta en la formación de bacatina III.
En resumen, este estudio, que ha sido publicado en Science Recientemente, combina múltiples análisis ómicos y una extensa validación funcional para identificar con éxito enzimas clave faltantes en la vía biosintética del paclitaxel. Revela un nuevo mecanismo mediante el cual las células vegetales catalizan la formación de anillos de oxetano y descubre la ruta más corta para la biosíntesis heteróloga de paclitaxel.
Al coexpresar nueve enzimas centrales en el tabaco, los investigadores logran la bioproducción de la baccatina III, precursora del paclitaxel, sentando las bases para la producción a gran escala de paclitaxel y también brindando orientación teórica para estudios biosintéticos sobre cientos de otros productos naturales de taxanos.
Más información: Bin Jiang et al, Caracterización y reconstitución heteróloga de enzimas biosintéticas de Taxus que conducen a bacatina III, Ciencia (2024). DOI:10.1126/ciencia.adj3484
Información de la revista: Ciencia
Proporcionado por la Universidad de Pekín