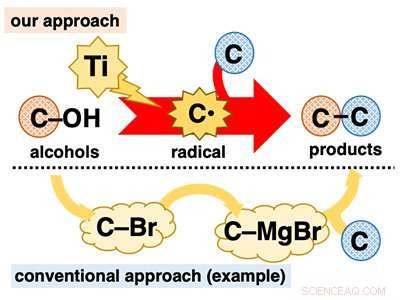
Uso directo de alcoholes para reacciones de formación de enlaces C-C. Crédito:Universidad de Kanazawa
Los alcoholes juegan un papel fundamental en la síntesis orgánica porque son ubicuos y pueden usarse en una variedad de transformaciones bien establecidas. Sin embargo, en reacciones de formación de enlaces C-C, a pesar de ser fundamental para la síntesis orgánica, los alcoholes se emplean mayoritariamente de forma indirecta. Muchas reacciones basadas en alcohol requieren una tediosa transformación previa del grupo hidroxi (C-OH) a otros grupos funcionales como los halógenos (p. Ej., C-Br) antes de la formación del enlace C-C (Figura 1).
El desarrollo de reacciones de formación de enlaces C-C de un solo paso usando alcoholes es muy deseable porque se da cuenta de la aplicación de materiales ubicuos sin la carga de un procedimiento de múltiples pasos. Una forma de lograr este objetivo es convertir directamente los alcoholes en intermedios reactivos conocidos que se someten instantáneamente a reacciones de formación de enlaces C-C. Imaginamos que podríamos lograr esto utilizando reactivos de titanio de baja valencia. El titanio de baja valencia es un reductor de un electrón y una especie muy oxofílica. Debido a estas características, se espera que el titanio de baja valencia pueda extraer un átomo de oxígeno del alcohol, escindir el enlace C-O en una reducción de un electrón para generar el radical de carbono correspondiente (C *). El radical de carbono es un intermedio extremadamente reactivo que se somete fácilmente a diversas reacciones, incluida la formación de enlaces C-C.
Resultados
El tratamiento de 2-naftalenometanol con un reactivo de titanio de baja valencia proporcionó una mezcla de dos productos escindidos con C-O de hidrogenación y dimerización (Figura 2). Estas reacciones en sí mismas no fueron muy útiles; sin embargo, ambos eran evidencia de la generación de especies de radicales bencilo. Con este resultado preliminar, esperábamos que la adición de agentes atrapadores de radicales proporcionaría los productos de acoplamiento entre el radical bencilo y los agentes atrapadores, interrumpiendo las reacciones de hidrogenación y dimerización. En efecto, la adición de acrilonitrilo como agente de captura dio el producto de acoplamiento entre el radical bencilo y el acrilonitrilo como producto predominante.
El mejor resultado se obtuvo cuando el reactivo de titanio de baja valencia se preparó a partir de TiCl4 (colidina) y polvo de manganeso. Esta reacción de formación de enlaces C-C directa basada en alcohol se aplicó con éxito a una serie de derivados de alcohol bencílico. Notablemente, ambos alcoholes bencílicos con sustituyentes donantes y extractores de electrones en el anillo aromático eran adecuados para esta reacción. Es más, además de alcoholes primarios, Los alcoholes secundarios y terciarios también eran adecuados a pesar del considerable aumento del impedimento estérico. Varios alquenos deficientes en electrones distintos del acrilonitrilo también fueron buenos reactivos. Con respecto a la practicidad, esta reacción es rentable y fácil de realizar, al menos a escala de laboratorio. TiCl 4 (colidina) es estable durante el almacenamiento, tolerante a una breve exposición al aire, y cuesta solo aproximadamente 10 JPY / mmol.
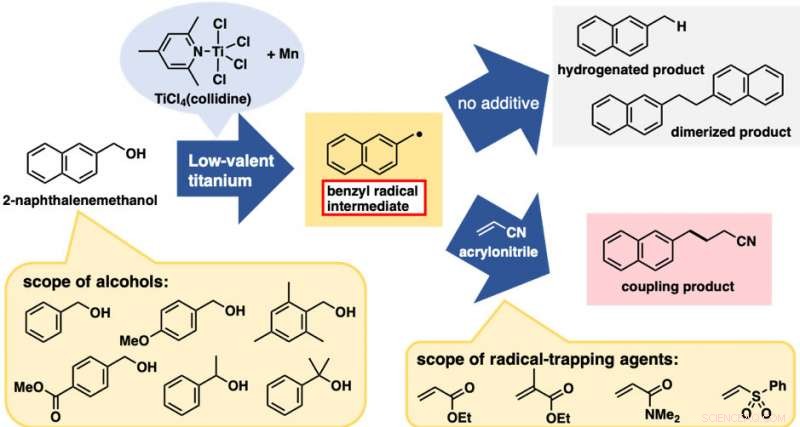
Reacciones de formación de enlaces C-C de radicales directos a base de alcohol. Flecha superior:reacciones sin agente atrapador. Flecha inferior:reacciones con agentes atrapadores de radicales (alquenos deficientes en electrones). Crédito:Universidad de Kanazawa
Importancia y perspectivas futuras
La importancia de este método es que permite el uso directo de alcoholes como equivalentes de radicales de carbono. Hemos relacionado los alcoholes ubicuos con el conocimiento acumulado sobre reacciones radicales. Creemos que este trabajo impulsará la investigación de otras reacciones radicales basadas en el alcohol en un futuro próximo.