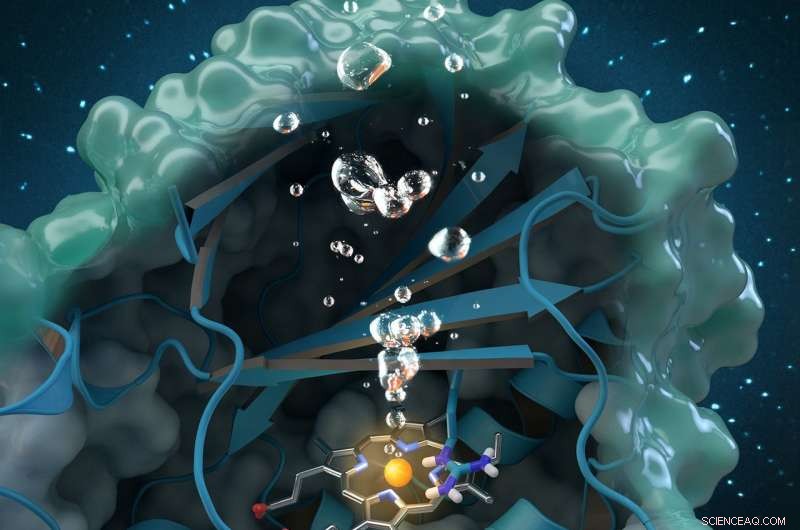
La clorita dismutasa es una enzima generadora de oxígeno única que degrada la clorita, un contaminante industrial que se encuentra a nivel mundial en las aguas subterráneas, agua potable y suelos. La investigación realizada en ORNL contribuye a un análisis estructural y bioquímico integral de la enzima, allanando el camino para futuras aplicaciones medioambientales. Crédito:Arte de la portada de la revista reimpreso con permiso de Catálisis ACS , vol. 7, número 11, 3 de noviembre 2017.
Un nuevo estudio arroja luz sobre una enzima única que podría proporcionar un tratamiento ecológico para los suministros de agua contaminados con clorito y mejorar la calidad del agua en todo el mundo.
Un equipo internacional de investigadores dirigido por Christian Obinger de la Universidad de Viena utilizó análisis de neutrones en el Laboratorio Nacional de Oak Ridge, cristalografía de rayos X y otras técnicas para estudiar la enzima clorito dismutasa. Esta proteína natural puede descomponer el clorito, un contaminante industrial que se encuentra en las aguas subterráneas, agua potable y suelos, en subproductos inofensivos, pero su proceso catalítico no se comprende bien. Comprender cómo la enzima bacteriana convierte el clorito en cloruro y oxígeno podría abrir posibilidades para futuras aplicaciones en biorremediación y biotecnología.
Los resultados, publicado en Catálisis ACS , también contribuyen a la investigación fundamental sobre la capacidad de la enzima para producir oxígeno. La generación de oxígeno es increíblemente rara en la naturaleza, una vez que se pensó posible solo mediante la fotosíntesis, por lo que la actividad enzimática de la clorito dismutasa ha atraído el interés de la comunidad científica más allá de sus aplicaciones ambientales para el agua limpia.
Desde que se descubrió la enzima en 1996 se ha debatido exactamente cómo funciona la clorita dismutasa a nivel molecular para descomponer la clorita. La complejidad de la estructura molecular de la enzima y la dificultad de estudiar proteínas con métodos experimentales presentan desafíos inherentes para los investigadores.
Como la mayoría de las enzimas, La clorita dismutasa es una proteína que cataliza una reacción muy específica. El proceso a menudo depende del medio ambiente, lo que significa que funciona mejor dentro de parámetros específicos, incluida la temperatura, rangos de concentración y pH. Identificar los parámetros ideales para la reacción es clave para respaldar la bioingeniería y la producción a gran escala de clorito dismutasa para eliminar de manera segura el clorito del medio ambiente y potencialmente explotar la generación de oxígeno de la enzima.
El equipo aisló una cepa Cyanothece no estudiada de clorito dismutasa y examinó la estructura cristalina de la proteína a valores de pH específicos para determinar el impacto del pH en la conversión de clorito.
Los investigadores utilizaron MaNDi, el difractómetro de neutrones macromolecular, línea de luz 11-B en la fuente de neutrones de espalación, una instalación de usuario del Departamento de Energía en ORNL, para recopilar datos únicos que solo se pueden obtener mediante el uso de neutrones.
"Los diferentes cristales de proteínas tienen diferentes grados de simetría, lo que determinará cómo vamos a medirlos. Este cristal es inusual porque tiene muy poca simetría, por lo que es necesario registrar una gran cantidad de reflexiones individualmente para obtener un conjunto de datos completo, "dijo Leighton Coates, Científico principal de instrumentos de MaNDi. "Esta sería una tarea larga y desafiante en cualquier lugar, y sólo se pudo lograr en este período de tiempo debido a la gran área de cobertura del detector del instrumento MaNDi ".
En MaNDi, los investigadores pudieron detectar los estados de protonación de importantes aminoácidos que se cree que apoyan la reacción. "Protonación" se refiere a un paso fundamental en la catálisis durante el cual el hidrógeno se adhiere a las moléculas. "Esta es la región importante de la proteína, donde ocurre la química y se descompone el clorito, "dijo Coates.
Los estados de protonación no se observan fácilmente porque involucran hidrógeno, que es difícil de detectar con rayos X u otras técnicas. Además, un fenómeno llamado "fotorreducción" ocurre cuando se exponen enzimas que contienen metales como la clorita dismutasa a los rayos X, esencialmente cambiando la estructura atómica de la muestra.
Debido a que las técnicas de neutrones no tienen estas limitaciones, pueden proporcionar a los investigadores información clave que no se puede obtener con otros métodos. "Los neutrones no son destructivos y sensibles a elementos ligeros como el hidrógeno, para que puedan proporcionar información exclusiva sobre la estructura atómica de las proteínas, que están compuestos en gran parte por moléculas de hidrógeno, "Coates explicó.
"Y a diferencia de los rayos X que pueden dañar las proteínas delicadas, Las técnicas de neutrones le permiten recopilar datos a temperatura ambiente sobre una proteína inalterada en su estado activo sin los impactos de la radiación ionizante y la fotorreducción. ", dijo Coates." Este experimento realmente destaca el beneficio de usar neutrones para estudiar proteínas ".