Los investigadores del Boston College utilizaron una suave carga de electricidad para modificar con precisión las proteínas, una nueva herramienta que puede usarse para desarrollar nuevas bioterapéuticas y herramientas de investigación basadas en proteínas, informó recientemente el equipo en la revista Nature Chemistry. .
El equipo, dirigido por los profesores de química de BC Abhishek Chatterjee y Eranthie Weerapana, desarrolló y optimizó una nueva reacción electroquímica de etiquetado de proteínas llamada "eCLIC" que permite la modificación precisa de residuos de 5-hidroxitriptófano (5HTP) incorporados en un sitio específico en muchas proteínas diferentes, incluidas las completas. -anticuerpos terapéuticos de longitud.
"Utilizamos esta estrategia para generar muchos conjugados de proteínas de sitio específico, incluido un conjugado de anticuerpo y fármaco citotóxico que ingresa selectivamente y mata las células cancerosas, pero no las células no cancerosas", dijo Chatterjee. "Una ventaja clave de eCLIC es que los reactivos necesarios para este método son realmente económicos y cuestan menos de 10 dólares el gramo".
El éxito del equipo marcó la primera vez que se utilizó la electrocatálisis para lograr la modificación de proteínas en un sitio específico, informaron en su artículo "Electrochemical labeling of hidroxiindoles with chemoselectivity for site-specific protein bioconjugation".
Las proteínas son moléculas grandes, típicamente compuestas por cientos de monómeros de aminoácidos, señaló Chatterjee. La capacidad de modificar selectivamente proteínas en sitios predefinidos es importante para muchas aplicaciones. Por ejemplo, al unir covalentemente medicamentos tóxicos a anticuerpos, ha sido posible administrarlos selectivamente a las células cancerosas, lo que resultó en una mayor eficacia terapéutica y una reducción de la toxicidad fuera del objetivo.
Muchas aplicaciones de investigación también requieren la conexión de sondas biofísicas a diversas proteínas. La capacidad de definir el sitio de modificación de las proteínas es fundamental para garantizar que no se dañen funciones importantes de las proteínas, afirmó Chatterjee.
"El desafío surge del hecho de que todas las proteínas están formadas por 20 aminoácidos en diversas combinaciones", dijo. "Identificar una funcionalidad modificable en el sitio deseado, que no se repite en otros lugares, suele ser un desafío, lo que dificulta lograr la especificidad del sitio en la modificación de proteínas".
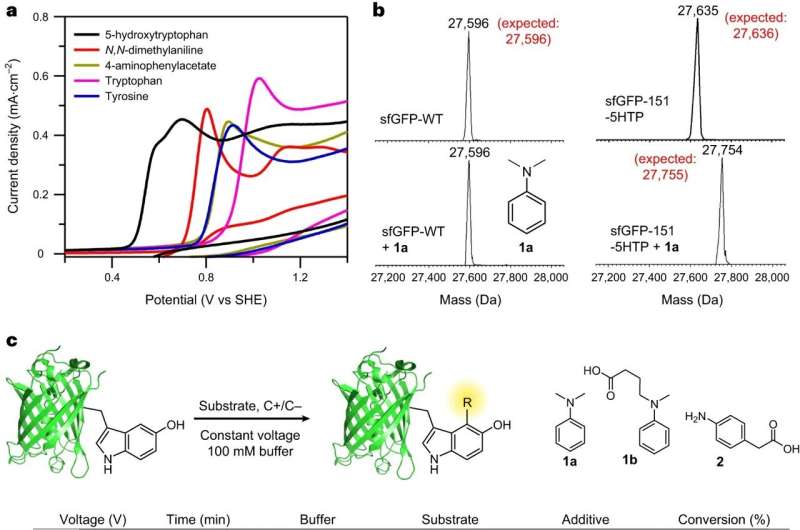
Para superar estos desafíos, el equipo buscó desarrollar un método para incorporar un aminoácido no natural en cualquier sitio elegido de una proteína. El equipo logró esto rediseñando el sistema de traducción de las células para acomodar el nuevo aminoácido 5HTP.
Además, los investigadores querían diseñar reacciones químicas que pudieran usarse para modificar selectivamente este aminoácido no natural en presencia de todos los aminoácidos naturales, dijo Chatterjee.
"Si pudiéramos hacer esto, podríamos proporcionar un método general para generar proteínas con un 'mango de conexión' incorporado en un sitio predefinido. En particular, estábamos interesados en desarrollar una reacción que usaría electricidad para catalizar la modificación de la proteína. reacción en lugar de catálisis química, ya que la primera es económica, respetuosa con el medio ambiente y respetuosa con las proteínas delicadas."
Chatterjee dijo que el equipo pudo superar un desafío inusual cuando intentaron por primera vez modelar la reacción. Normalmente, los investigadores comienzan con moléculas pequeñas, en este caso, 5HTP y anilina, y luego pasan a proteínas grandes.
Pero los primeros intentos de reacción entre 5HTP y anilinas a nivel de molécula pequeña fueron complicados, ya que las moléculas de 5HTP reaccionaban preferentemente entre sí. Pero cuando el 5HTP se incorporó a una proteína grande, ya no pudo reaccionar con otro 5HTP unido a una proteína y en su lugar reaccionó limpiamente con una anilina, informó el equipo.
"Si nos hubiéramos quedado con la progresión tradicional, de pequeño a grande, nunca habríamos seguido eCLIC, pensando que 'es demasiado complicado'", dijo Chatterjee. "En lugar de ello, desarrollamos nuestra reacción de forma no tradicional, directamente en una proteína, lo que nos ayudó a darnos cuenta de lo limpia y selectiva que era en este entorno".
Para avanzar aún más en la estrategia eCLIC para la modificación a gran escala de objetivos proteicos importantes, se ha otorgado la licencia de esta tecnología a BrickBio, Inc., que Chatterjee cofundó. La investigación futura se centrará en el desarrollo de reactivos de investigación y bioterapéuticos basados en proteínas modificadas para sitios específicos de próxima generación.
Más información: Conor Loynd et al, Marcado electroquímico de hidroxiindoles con quimioselectividad para bioconjugación de proteínas de sitio específico, Nature Chemistry (2023). DOI:10.1038/s41557-023-01375-y
Proporcionado por Boston College