Cualquiera que quiera producir medicamentos, plásticos o fertilizantes utilizando métodos convencionales necesita calor para las reacciones químicas, pero no así con la fotoquímica, donde la luz proporciona la energía. El proceso para lograr el producto deseado también suele requerir menos pasos intermedios.
Investigadores de la Universidad de Basilea van un paso más allá y demuestran cómo se puede multiplicar por 10 la eficiencia energética de las reacciones fotoquímicas. Aplicaciones más sostenibles y rentables están tentadoramente cerca.
Las reacciones químicas industriales suelen ocurrir en varias etapas en varios productos intermedios. La fotoquímica permite atajos, lo que significa que se requieren menos pasos intermedios. La fotoquímica también permite trabajar con sustancias menos peligrosas que en la química convencional, ya que la luz produce una reacción en sustancias que no reaccionan bien con el calor. Sin embargo, hasta el momento no ha habido muchas aplicaciones industriales para la fotoquímica, en parte porque el suministro de energía con luz suele ser ineficiente o crea subproductos no deseados.
El grupo de investigación dirigido por el profesor Oliver Wenger de la Universidad de Basilea describe ahora un principio fundamental que tiene un impacto inesperadamente fuerte en la eficiencia energética de la fotoquímica y puede aumentar la velocidad de las reacciones fotoquímicas. Sus resultados se publican en Nature Chemistry. .
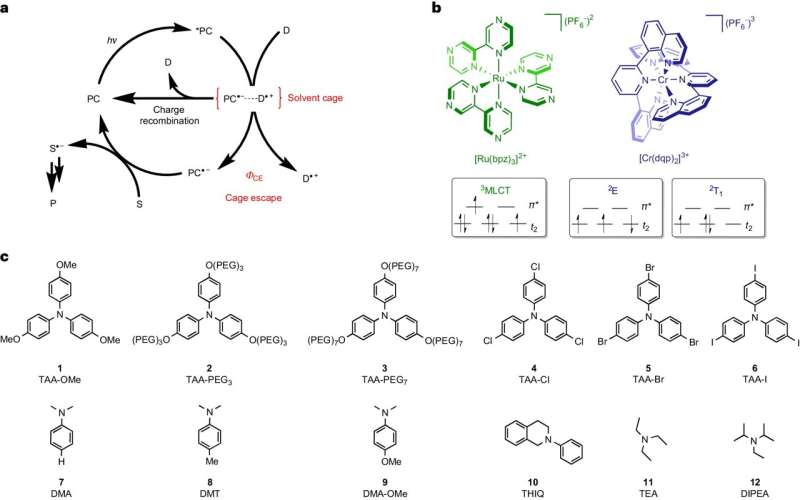
En el caso de este tipo de reacción, las moléculas de partida se encuentran en una solución líquida. Si reciben energía en forma de luz, pueden intercambiar electrones entre sí y formar radicales. Estas moléculas extremadamente reactivas siempre se presentan en pares y permanecen rodeadas de disolvente, que encierra los pares de radicales como una especie de jaula.
Para que los radicales puedan seguir reaccionando con los productos objetivo deseados, necesitan "salir" de esta jaula y encontrar un compañero de reacción fuera de ella. El equipo que rodea a Wenger y su postdoctorado, el Dr. Cui Wang, identificó este proceso de ruptura como un paso decisivo que limita la eficiencia energética y la velocidad de las reacciones fotoquímicas.
Mientras los radicales permanezcan en pares en la jaula del disolvente, pueden reaccionar espontáneamente entre sí para formar los materiales de partida. Esta reacción inversa desperdicia energía porque sólo utiliza la luz ya absorbida para volver al punto de partida.
El equipo de Basilea supo frenar esta reacción inversa y así dar a los radicales más tiempo para salir de la jaula. Cuanto más larga era la reacción inversa no deseada, más radicales podían liberarse y más eficientes energéticamente y más rápido se desarrollaban los productos objetivo deseados.
Wang, que ahora ocupa el puesto de profesora asistente en la Universidad de Osnabrück, utilizó dos tintes particulares en su estudio, los cuales absorben la luz y almacenan su energía durante un corto período antes de usarla para formar pares de radicales. Sin embargo, uno de los dos tintes examinados fue capaz de almacenar significativamente más energía que el otro y transferirla a los radicales.
Gracias a la energía adicional, los radicales pudieron salir de la jaula del disolvente hasta diez veces más eficientemente. En consecuencia, los productos objetivo se fabrican con una eficiencia energética hasta diez veces mayor. "Este vínculo directo entre los radicales que se desprenden de la jaula del disolvente y la formación eficiente de los productos objetivo es sorprendentemente claro", afirmó Wang.
El hallazgo clave es que ciertos tintes pueden liberar más radicales que otros según la cantidad de luz absorbida. "La elección del tinte puede utilizarse para aumentar la eficiencia energética de las reacciones fotoquímicas", afirmó Wenger. A su vez, afirma que la eficiencia energética también es un criterio decisivo para el uso industrial de la fotoquímica.
Más información: El escape de la jaula gobierna las velocidades de reacción fotoredox y los rendimientos cuánticos, Nature Chemistry (2024). DOI:10.1038/s41557-024-01482-4
Proporcionado por la Universidad de Basilea