Los catalizadores de óxido de iridio son eficaces para la oxidación del agua, lo que los hace muy atractivos para las tecnologías ecológicas. Por lo tanto, un equipo que incluye investigadores de SANKEN (Instituto de Investigación Científica e Industrial) de la Universidad de Osaka ha analizado más de cerca cómo funcionan.
En un estudio publicado en el Journal of the American Chemical Society El equipo utilizó espectroscopía para revelar cómo las especies químicas involucradas en la reacción de evolución de oxígeno (REA) catalizada por óxido de iridio interactúan con la solución que las rodea.
Los REA son importantes en muchos procesos de energía limpia, como convertir el dióxido de carbono en combustibles líquidos utilizables y generar hidrógeno verde a partir de la electrólisis del agua. Ambos procesos serán cruciales en un futuro sin combustibles fósiles. Por lo tanto, comprender a fondo los REA es un importante foco de investigación.
Los procesos catalíticos pueden ser complejos con varias especies intermedias involucradas en pasar del material de partida al producto deseado. Las técnicas de operando permiten investigar estos intermediarios mediante espectroscopia durante la reacción, lo que proporciona una ventana a lo que realmente está sucediendo.
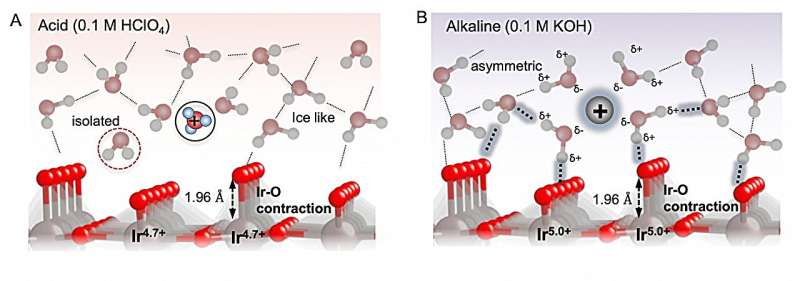
Utilizando un electrodo con una superficie de óxido de iridio, los investigadores investigaron la oxidación de moléculas de agua en soluciones con diferentes valores de pH.
"La interacción entre la superficie del electrodo y los intermedios oxigenados es clave para la eficiencia del REA, por lo que generalmente el objetivo ha sido optimizar el material del catalizador", explica la autora principal Reshma R. Rao del Imperial College de Londres.
"Sin embargo, las observaciones hasta la fecha han dejado preguntas sin respuesta, por lo que hemos examinado más de cerca el lado de la solución de la interfaz utilizando espectroscopia operando UV-Vis, espectroscopia de absorción de rayos X y espectroscopia infrarroja de superficie mejorada".
Para lograr una reacción eficiente, la unión de los intermediarios de la reacción al electrodo debe ser la adecuada para permitir que los intermediarios interactúen con el electrodo, pero no ser tan fuerte como para que se peguen al electrodo y no puedan reaccionar. Los investigadores descubrieron que la unión estaba controlada por interacciones de largo alcance entre los intermediarios a través de la solución y esto dependía del pH.
En condiciones alcalinas, el agua cerca del electrodo influyó en las interacciones de largo alcance entre las especies oxigenadas, lo que afectó su unión a la superficie. Entonces, aunque los intermediarios se unen con más fuerza a un pH más alto, las interacciones facilitadas por el agua interfacial desestabilizan las especies oxigenadas y permiten que se lleve a cabo la reacción.
"El uso de espectroscopia operando y técnicas complementarias para observar directamente las especies involucradas nos ha permitido ampliar la comprensión del rendimiento del catalizador más allá de la unión de los electrodos", dice el autor principal Yu Katayama. "Creemos que esa información será la clave para optimizar la cinética de los REA".
Los hallazgos contribuirán a aumentar la eficiencia de la oxidación del agua para la producción de hidrógeno verde. Además, combinar la espectroscopia operando con técnicas complementarias puede resultar útil para comprender la catálisis de muchos otros procesos.
Más información: Caiwu Liang et al, Papel del pH del electrolito en la oxidación del agua para óxidos de iridio, Revista de la Sociedad Química Estadounidense (2024). DOI:10.1021/jacs.3c12011
Información de la revista: Revista de la Sociedad Química Estadounidense
Proporcionado por la Universidad de Osaka