Los bioquímicos llevan mucho tiempo trabajando para solucionar un punto ciego en lo que respecta a las proteínas. Saben que el hidrógeno constituye casi la mitad de los átomos de las proteínas, pero no está tan claro cómo contribuyen a la función de las proteínas en estas estructuras complejas. Los átomos de hidrógeno son tan pequeños que las técnicas tradicionales de biología estructural no pueden revelar sus posiciones.
"Así que te estás perdiendo la mitad de la información", dijo la Dra. Victoria Drago, investigadora asociada postdoctoral en el Laboratorio Nacional Oak Ridge (ORNL) en Tennessee y reciente alumna de la Universidad de Toledo.
No tener una contabilidad completa de las ubicaciones de los átomos de hidrógeno de una proteína es un enigma con implicaciones más allá del laboratorio, incluido el diseño de fármacos basado en estructuras.
Drago comenzó a explorar una técnica para identificar hidrógenos que de otro modo serían esquivos y que implicaban el crecimiento de cristales de proteínas en microgravedad como estudiante de posgrado junto con el Dr. Timothy Mueser, profesor del Departamento de Química y Bioquímica de UToledo.
El análisis de esos cristales (un término químico que en este caso se refiere a la disposición precisa de los átomos y moléculas que los constituyen) es la base de un artículo de investigación publicado recientemente en la revista Cell Reports Physical Science. .
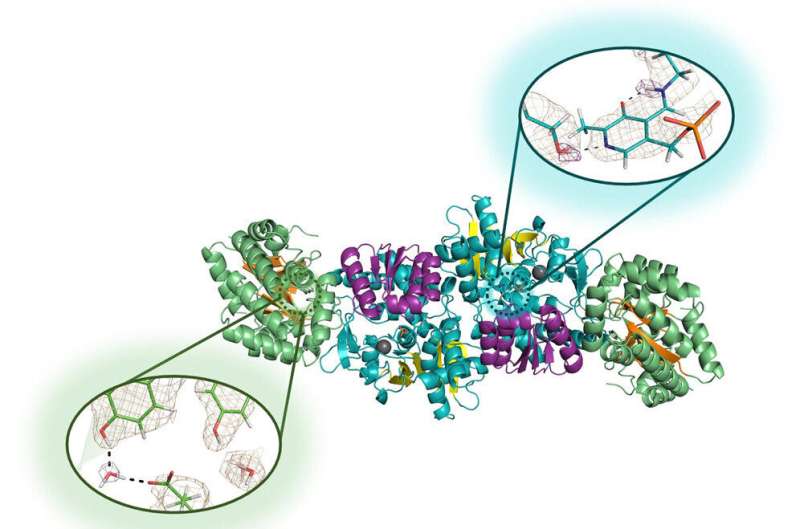
"Utilizamos difracción de neutrones", dijo Drago, autor principal del artículo y que se doctoró en química en 2022. "Pudimos realizar el experimento y lograr una alta resolución aprovechando la microgravedad para cultivar cristales de alta calidad". de la enzima."
La difracción de neutrones es un proceso de alta tecnología que permite a los investigadores trazar un mapa de las ubicaciones precisas de cada átomo de una molécula. Funciona para identificar las ubicaciones de pequeños átomos de hidrógeno, como ocurre con otros átomos, pero la señal es extremadamente débil en las técnicas tradicionales de biología estructural. Por eso recurrieron a la microgravedad, que permite el crecimiento de cristales más grandes y perfectamente estructurados.

Drago, Mueser y sus colaboradores en ORNL y el Institut Laue-Langevin, una instalación líder en investigación nuclear en Grenoble, Francia, enviaron soluciones de la enzima triptófano sintasa para una gira de un mes en la Estación Espacial Internacional en 2018, y nuevamente para una viaje de seis meses entre 2019 y 2020. El segundo viaje produjo varios cristales muy grandes y perfectos (muchos de ellos de aproximadamente un milímetro cúbico, cinco veces más grandes que los que los investigadores cultivaron en los laboratorios) que viajaron más de 50 millones de millas y sobrevivieron a un amerizaje de 9G en el Océano Pacífico.
La difracción de neutrones resultó exitosa en estos cristales, lo que permitió a los investigadores revelar por primera vez los hidrógenos del sitio activo de la enzima que eligieron estudiar.
La triptófano sintasa es científicamente valiosa como representante de una familia de enzimas grande y muy versátil que utiliza la vitamina B6 para funcionar. Debido a que los seres humanos no producen triptófano sintasa, también resulta atractivo para los diseñadores de fármacos interesados en aprovechar la estructura química de las proteínas en el desarrollo de nuevos compuestos para combatir microorganismos patógenos como Salmonella enterica, Staphylococcus aureus y Mycobacterium tuberculosis.
Más información: Victoria N. Drago et al, La difracción de neutrones de un cristal cultivado en microgravedad revela los hidrógenos del sitio activo de la forma aldimina interna de la triptófano sintasa, Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.101827
Información de la revista: Informes celulares de ciencias físicas
Proporcionado por la Universidad de Toledo