Los organismos multicelulares, como los animales y las plantas, tienen células complejas con diversas funciones. Esta complejidad surge de la necesidad de que las células produzcan proteínas distintas que interactúen entre sí. Esta interacción es crucial para que las células lleven a cabo sus tareas específicas y formen maquinaria molecular compleja.
Sin embargo, nuestra comprensión actual de tales interacciones proteína-proteína a menudo carece de contextos celulares porque generalmente se estudiaron en un sistema in vitro o en células aisladas de su entorno tisular. Faltan en gran medida métodos eficaces para investigar las interacciones proteína-proteína de manera específica para cada tejido.
Para cerrar esta brecha tecnológica, un equipo de investigación colaborativo de la Universidad de Hong Kong (HKU), dirigido por el profesor Xiang David Li del Departamento de Química y el profesor Chaogu Zheng de la Facultad de Ciencias Biológicas, ambos de la Facultad de Ciencias, junto con Junto con el Dr. Xiucong Bao de la Facultad de Ciencias Biomédicas de la Facultad de Medicina Li Ka Shing, desarrollaron recientemente un novedoso enfoque de biología química.
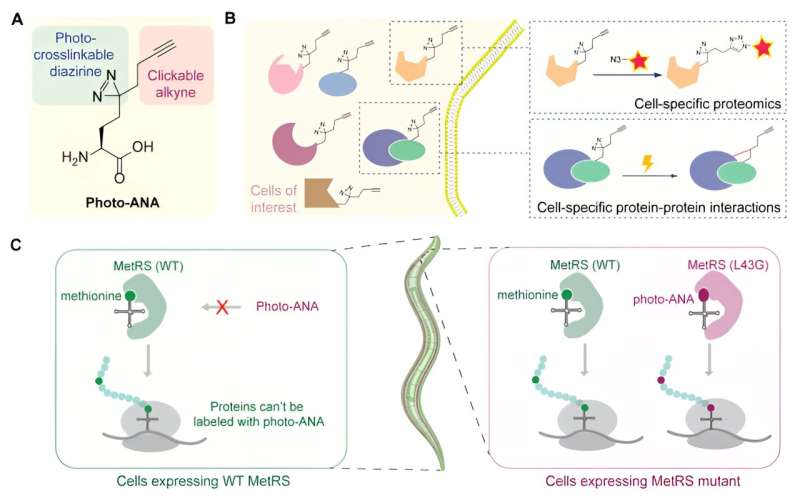
El equipo etiquetó proteínas de células específicas con una sonda de aminoácidos bifuncional que permite aislar las proteínas marcadas y captura las interacciones proteína-proteína mediante fotoentrecruzamiento.
Este nuevo método, proteómica e interactómica celular basada en análogos de metionina (MACSPI), ha permitido al equipo identificar muchas proteínas nuevas específicas de tejido e interacciones entre proteínas, lo que nos ayuda a comprender mejor cómo funcionan las células en los organismos vivos y a estudiar diversos problemas biológicos. como el desarrollo de órganos y la patogénesis de enfermedades.
El trabajo fue publicado recientemente en las Proceedings of the National Academy of Sciences .
El equipo diseñó y sintetizó un aminoácido no natural (foto-ANA) que es estructuralmente similar a la metionina, el aminoácido natural, pero con dos componentes adicionales.
Un componente es un grupo alquino, que se puede utilizar como elemento químico para extraer y purificar las proteínas marcadas. El otro es un grupo diazirina, que puede activarse con la luz para crear enlaces covalentes estables entre las proteínas marcadas y cualquier molécula con la que interactúen.
A continuación, el equipo diseñó una enzima llamada MetRS para crear una variante que pueda reconocer e incorporar el aminoácido no natural en las proteínas a medida que se construyen. Al controlar la expresión de esta enzima diseñada en tejidos específicos, solo las proteínas del tejido de interés se marcan mediante una sonda química. Además, con la reticulación inducida por la luz, se pueden capturar y aislar complejos proteicos de tejidos específicos.
Como prueba de concepto, el equipo aplicó el método MACSPI para perfilar proteínas de células musculares y neuronas, respectivamente, en un organismo modelo llamado C. elegans y encontró muchas proteínas novedosas específicas de tejido.
El equipo también demostró la utilidad del método para capturar la interacción proteína-proteína específica de tejido mediante la identificación de interactuantes específicos de tejido de una proteína expresada de forma ubicua, como la chaperona molecular llamada HSP90. Se descubrió que HSP90 se une a distintos conjuntos de proteínas para regular diferentes procesos biológicos en músculos y neuronas.
"Este estudio es un excelente ejemplo de cómo los métodos innovadores de etiquetado químico pueden ayudar a resolver problemas biológicos difíciles", afirmó el profesor Xiang David Li.
"Comprender la interacción proteína-proteína en la resolución celular es a menudo fundamental para descifrar el mecanismo molecular de un proceso patológico. Por ejemplo, actualmente estamos explorando las funciones de los interactores neuronales HSP90 que identificamos; algunos parecen estar involucrados en la neurodegeneración en una enfermedad de Parkinson. modelo de enfermedad", afirmó el profesor Chaogu Zheng.
El equipo prevé que el método MACSPI se pueda utilizar en muchos organismos multicelulares para perfilar proteomas e interactomas con especificidad espacial y temporal, lo que puede facilitar un amplio espectro de investigaciones biológicas y biomédicas.
Más información: Siyue Huang et al, MACSPI permite análisis proteómicos e interactómicos selectivos de tejidos en organismos multicelulares, Actas de la Academia Nacional de Ciencias (2024). DOI:10.1073/pnas.2319060121
Información de la revista: Actas de la Academia Nacional de Ciencias
Proporcionado por la Universidad de Hong Kong