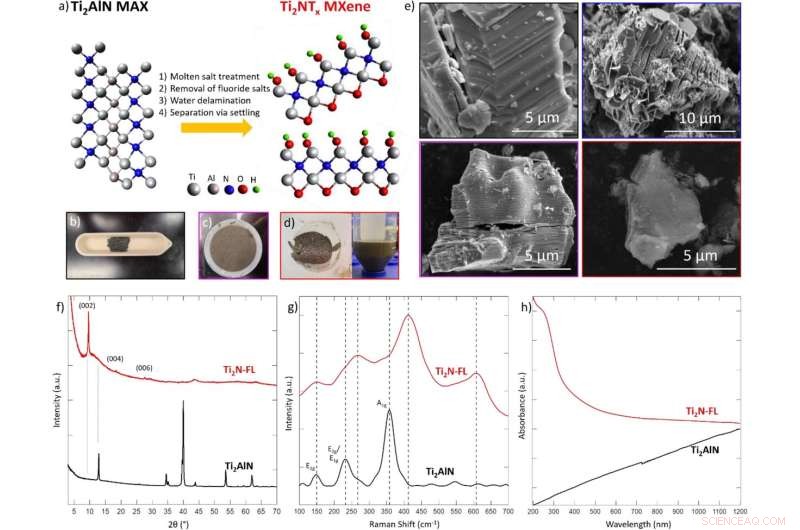
(a) Ilustración esquemática de la síntesis de Ti2NTx MXene a través del tratamiento con fluoruro de sal fundida asistido por oxígeno de la fase principal MAX Ti2AlN a 550 °C durante 5 h bajo flujo de argón, luego exposición al aire, seguida de eliminación de sal de fluoruro en H2SO4 4 M , finalmente, la delaminación se logra mediante sonicación en agua durante 4 h. Los modelos no se basan en datos recopilados, solo como una guía general. En fotografías de laboratorio de (b) fase MAX, (c) MXene Ti2N multicapa después del lavado con ácido, y (d) MXene de una sola capa adquirida después de la deslaminación en agua. (e) Imágenes SEM de la fase Ti2AlN MAX (contorno negro), fase MAX tratada con sal fundida (contorno azul), Ti2N MXene multicapa (contorno púrpura) y Ti2N MXene de pocas capas (contorno rojo). El tamaño lateral de los copos de MXene individuales es de aproximadamente 5 μm. ( f ) XRD, ( g ) Raman y ( h ) espectros UV-Vis de la fase Ti2AlN MAX (negro) y Ti2N MXene de una sola capa (rojo). La XRD se recolectó utilizando una placa de silicio de difracción cero con un pozo. La espectroscopia Raman se recopiló utilizando un láser de 532 nm a una potencia del 5 % con un tiempo de exposición de 1 s. La espectroscopia UV-Vis se recolectó utilizando agua como matriz. Crédito:Informes científicos (2022). DOI:10.1038/s41598-021-04640-7
El amoníaco se usa comúnmente en fertilizantes porque tiene el contenido de nitrógeno más alto de los fertilizantes comerciales, lo que lo hace esencial para la producción de cultivos. Sin embargo, se producen dos moléculas de dióxido de carbono por cada molécula de amoníaco producida, lo que contribuye al exceso de dióxido de carbono en la atmósfera.
Un equipo del Departamento de Ingeniería Química Artie McFerrin de la Universidad Texas A&M, integrado por el Dr. Abdoulaye Djire, profesor asistente y estudiante graduado Denis Johnson, ha desarrollado un método para producir amoníaco a través de procesos electroquímicos, lo que ayuda a reducir las emisiones de carbono. Esta investigación tiene como objetivo reemplazar el proceso termoquímico de Haber-Bosch por un proceso electroquímico más sostenible y seguro para el medio ambiente.
Los investigadores publicaron recientemente sus hallazgos en Scientific Reports .
Desde principios de 1900, el proceso Haber-Bosch se ha utilizado para producir amoníaco. Este proceso funciona haciendo reaccionar el nitrógeno atmosférico con gas hidrógeno. Una desventaja del proceso Haber-Bosch es que requiere alta presión y alta temperatura, lo que deja una gran huella energética. El método también requiere materia prima de hidrógeno, que se deriva de recursos no renovables. No es sostenible y tiene implicaciones negativas en el medio ambiente, lo que acelera la necesidad de procesos nuevos y respetuosos con el medio ambiente.
Los investigadores han propuesto utilizar la reacción electroquímica de reducción de nitrógeno (NRR) para producir amoníaco a partir de nitrógeno atmosférico y agua. Los beneficios de usar un método electroquímico incluyen el uso de agua para proporcionar protones y la capacidad de producir amoníaco a temperatura y presión ambiente. Este proceso requeriría potencialmente menos energía y sería menos costoso y más respetuoso con el medio ambiente que el proceso Haber-Bosch.
El NRR funciona mediante el uso de un electrocatalizador. For this process to succeed, nitrogen must bond to the surface and break apart to produce ammonia. In this study, the researchers used MXene, a titanium nitride, as the electrocatalyst. What differentiates this catalyst from others is that nitrogen is already in its structure, allowing for more efficient ammonia formulation.
"It's easier for ammonia to form because the protons can attach to the nitrogen in the structure, form the ammonia and then the ammonia will leave out of the structure," said Johnson. "A hole is made in the structure that can pull the nitrogen gas in and separate the triple bond."
The researchers found that using titanium nitride induces a Mars-van Krevelen mechanism, a popular mechanism for hydrocarbon oxidation. This mechanism follows a lower energy pathway that would allow for higher ammonia production rates and selectivity because of the nitrogen from the titanium nitride catalyst.
Without modifications to the materials, the researchers reached a selectivity of 20%, which is the ratio of the desired product formed compared to the undesired product formed. Their method could potentially reach a higher selectivity percentage with modifications, forging a new pathway to ammonia production through electrochemical processes.
"The Department of Energy has set a goal of a selectivity of 60%, which is a challenging number to reach," said Johnson. "We were able to reach 20% using our material, showcasing a method that we might be able to take advantage of moving forward. If we upgrade our material, can we reach 60% soon? That is the question we will continue to work to answer."
This research could potentially reduce the carbon footprint and global energy usage on a larger scale.
"In the future, this could be a major scientific reform," said Djire. "About 2% of the world's total energy is used for ammonia production. Reducing that huge number would drastically reduce our carbon footprint and energy consumption."
Other contributors to the publication are Eric Kelley from the chemical engineering department at Texas A&M, Brock Hunter from Auburn University, and Jevaun Christie and Cullan King from Prairie View A&M University. La nueva alquimia en carbono neutralidad:Convertir el agua en amoníaco solo con energía renovable