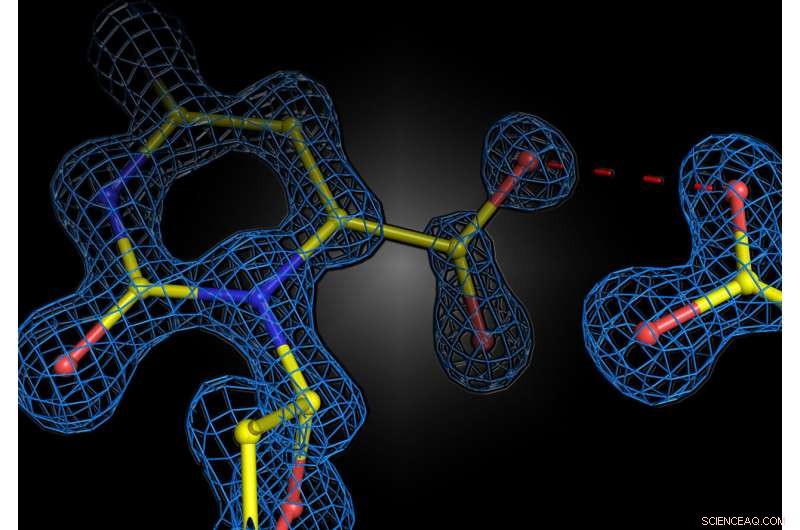
Instantánea estructural de la reacción enzimática en la enzima humana orotidina 5'-fosfato descarboxilasa. Las dos cargas negativas del sustrato y la enzima no se repelen, sino que forman una interacción atractiva. Crédito:Kai Tittmann
Es bien sabido en física y química que las cargas iguales se repelen, mientras que las cargas opuestas se atraen. Durante mucho tiempo se asumió que este principio también se aplica cuando las enzimas, los catalizadores biológicos en todos los organismos vivos, forman o rompen enlaces químicos. Se pensaba que las enzimas colocaban cargas en sus "centros activos", donde realmente tienen lugar las reacciones químicas, de tal manera que repelían cargas similares de las otras moléculas que las rodeaban. Este concepto se conoce como "estrés electrostático". Por ejemplo, si el sustrato (la sustancia sobre la que actúa la enzima) lleva una carga negativa, la enzima podría usar una carga negativa para "tensar" el sustrato y así facilitar la reacción. Sin embargo, un nuevo estudio de la Universidad de Göttingen y el Instituto Max Planck de Ciencias Multidisciplinarias de Göttingen ha demostrado ahora que, contrariamente a lo esperado, dos cargas iguales no necesariamente conducen a la repulsión, sino que pueden causar atracción en las enzimas. Los resultados se publicaron en la revista Nature Catalysis .
El equipo investigó una enzima bien conocida que se ha estudiado ampliamente y es un ejemplo de libro de texto de catálisis enzimática. Sin la enzima, la reacción es extremadamente lenta:de hecho, la mitad del sustrato tardaría 78 millones de años en reaccionar. La enzima acelera esta reacción en 10 17 veces, simplemente colocando cargas negativas y positivas en el centro activo. Dado que el sustrato contiene un grupo con carga negativa que se separa en forma de dióxido de carbono, durante décadas se asumió que las cargas negativas de la enzima sirven para estresar el sustrato, que también tiene carga negativa, y acelerar la reacción. Sin embargo, este mecanismo hipotético no se demostró porque la estructura de la reacción era demasiado rápida para ser observada.
El grupo del profesor Kai Tittmann en el Centro de Biociencias Moleculares de Göttingen (GZMB) ahora ha logrado por primera vez utilizar la cristalografía de proteínas para obtener una instantánea estructural del sustrato poco antes de la reacción química. Inesperadamente, las cargas negativas de la enzima y el sustrato no se repelieron entre sí. En cambio, compartieron un protón, que actuó como una especie de pegamento molecular en una interacción atractiva. "La cuestión de si dos cargas iguales son amigas o enemigas en el contexto de la catálisis enzimática ha sido controvertida durante mucho tiempo en nuestro campo, y nuestro estudio muestra que los principios básicos de cómo funcionan las enzimas todavía están muy lejos de ser entendidos", dice Tittmann. . Las estructuras cristalográficas fueron analizadas por el profesor de química cuántica Ricardo Mata y su equipo del Instituto de Química Física de la Universidad de Göttingen. “El protón adicional, que tiene una carga positiva, entre las dos cargas negativas no solo se usa para atraer a la molécula involucrada en la reacción, sino que desencadena una cascada de reacciones de transferencia de protones que aceleran aún más la reacción”, explica Mata.
"Creemos que estos principios recién descritos de la catálisis enzimática ayudarán en el desarrollo de nuevos catalizadores químicos", dice Tittmann. "Dado que la enzima que estudiamos libera dióxido de carbono, el gas de efecto invernadero más importante producido por las actividades humanas, nuestros resultados podrían ayudar a desarrollar nuevas estrategias químicas para la fijación de dióxido de carbono". Catalizadores enzimáticos híbridos sintetizados mediante un enfoque de novo para expandir la biocatálisis