
Rociar sal en las carreteras es una medida de seguridad. Crédito:stoatphoto / Shutterstock.com
Brrr… ¡hace frío ahí fuera! Los niños acuden en masa a la televisión con la esperanza de escuchar que habrá un día de nieve; los pasillos de pan y leche en las tiendas de comestibles están vacíos debido a una inminente tormenta de nieve; y los camiones utilitarios están rociando sal o agua salada en las carreteras.
Todos sabemos por qué suceden los dos primeros:los niños están emocionados por un día fuera de la escuela lleno de chocolate caliente y muñecos de nieve. Los adultos se abastecen de artículos de primera necesidad. Pero, ¿qué pasa con esos camiones?
Están trabajando para proteger a los conductores de condiciones resbaladizas rociando sal de roca o una solución de agua salada para evitar la formación de hielo. Esta sal es muy similar a la sal que tiene en la mesa:es el mismo cloruro de sodio, NaCl. Hay algunas mezclas patentadas que contienen otras sales, como cloruro de potasio (KCl) y cloruro de magnesio (MgCl), pero no se usan con tanta frecuencia.
La sal para carreteras no es tan pura como la que usa en sus alimentos; tiene un color gris pardusco, principalmente debido a la contaminación mineral. Someter el medio ambiente a esta sal a través de la escorrentía puede tener algunas consecuencias no deseadas, incluidos efectos negativos en las plantas, animales acuáticos y humedales.
Pero es una forma barata y eficaz de proteger las carreteras del hielo debido a un principio científico simple:la depresión del punto de congelación de las soluciones. El punto de congelación del agua pura, la temperatura a la que se convierte en hielo, es 32 grados Fahrenheit. Entonces, si hay nieve aguanieve o lluvia helada y el suelo está a 32 F o más frío, Se formará hielo sólido en calles y aceras.
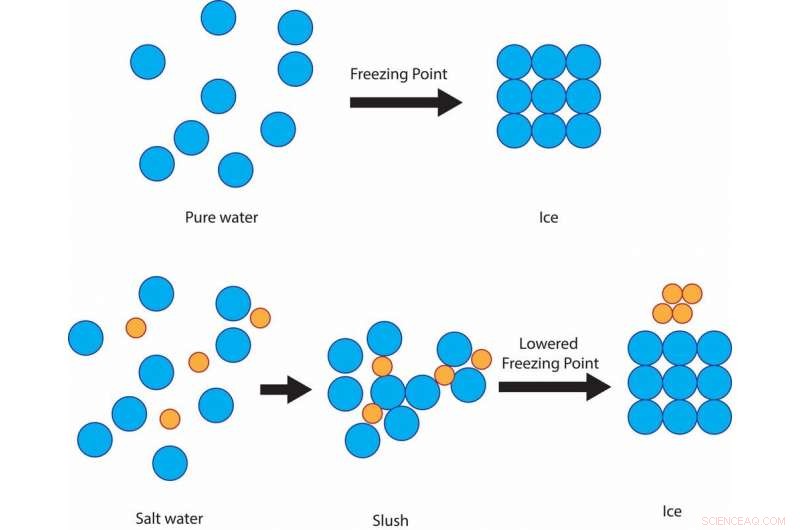
La sal evita que las moléculas de agua se solidifiquen en cristales de hielo a 32 F, en lugar de permanecer fangoso a esa temperatura, antes de finalmente congelarse alrededor de las 15 F. Crédito:Julie Pollock, CC BY-ND
Si el agua se mezcla con sal, aunque, la temperatura de congelación de la solución es inferior a 32 ° F. La sal impide la capacidad de las moléculas de agua para formar cristales de hielo sólidos. El grado de depresión del punto de congelación depende de qué tan salada sea la solución.
Es importante tener en cuenta que la sal debe estar en una solución con agua líquida para que se obedezca este principio. Es por eso que muchas ciudades rocían una solución salina antes de que se forme hielo.
La sal que se vierte sobre el hielo depende del sol o de la fricción de las llantas de los automóviles que lo sobrepasan para derretir inicialmente el hielo en un aguanieve que se puede mezclar con la sal y luego no se volverá a congelar. El pretratamiento con sal sólida se basa en la superficie de la carretera más cálida para derretir inicialmente la nieve o la lluvia helada para que se pueda mezclar correctamente con la sal. Esta es también la razón por la que el tratamiento previo de los puentes, que son más fríos que otras carreteras, no suele funcionar. y por qué ves las señales de "el puente se congela antes que la carretera".
Estas soluciones salinas reducen la temperatura de congelación del agua a alrededor de 15 ° F. Entonces, desafortunadamente para las personas que enfrentan temperaturas realmente frías, el tratamiento con sal no eliminará el hielo en sus carreteras.
Una estrategia alternativa utilizada a estas temperaturas más bajas es poner arena en el hielo. La arena no cambia la temperatura de fusión simplemente proporciona una superficie rugosa para sus neumáticos para evitar resbalones y deslizamientos.
La ciencia de la depresión del punto de congelación se puede aplicar a cualquier solución, y muchos grupos de investigación se han centrado en desarrollar alternativas con menos consecuencias ambientales negativas. Incluyen aditivos como melaza y jugo de remolacha. Entonces, tal vez pueda esperar limpiar no solo la sal blanca de la parte inferior de sus jeans después de una caminata de invierno, pero también sal rosa.
Este artículo se ha vuelto a publicar de The Conversation con una licencia de Creative Commons. Lea el artículo original. 