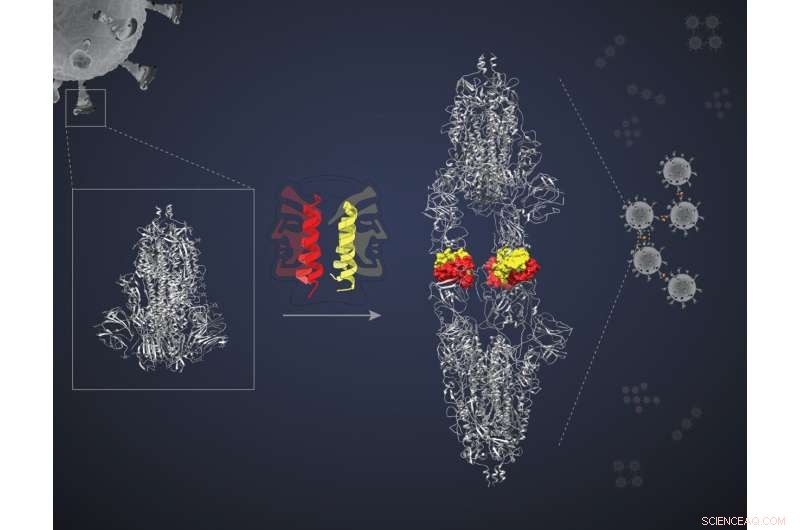
Dimerización de la proteína de pico por 'péptido de dos caras'. Crédito:Bhavesh Khatri
La rápida aparición de nuevas cepas del virus SARS-CoV-2 ha disminuido la protección que ofrecen las vacunas contra la COVID-19. Un nuevo enfoque desarrollado por investigadores del Instituto Indio de Ciencias (IISc) ahora proporciona un mecanismo alternativo para inactivar virus como el SARS-CoV-2.
En un estudio publicado en Nature Chemical Biology , los investigadores informan sobre el diseño de una nueva clase de péptidos artificiales o miniproteínas que no solo pueden bloquear la entrada de virus en nuestras células, sino también agrupar viriones (partículas de virus), reduciendo su capacidad de infectar.
Una interacción proteína-proteína es a menudo como la de un candado y una llave. Esta interacción puede verse obstaculizada por una miniproteína fabricada en laboratorio que imita, compite y evita que la "llave" se una a la "cerradura", o viceversa.
En el nuevo estudio, el equipo ha explotado este enfoque para diseñar miniproteínas que pueden unirse y bloquear la proteína de punta en la superficie del virus SARS-CoV-2. Esta unión se caracterizó más extensamente mediante microscopía crioelectrónica (crio-EM) y otros métodos biofísicos.
Estas miniproteínas son péptidos helicoidales en forma de horquilla, cada uno capaz de emparejarse con otro de su tipo, formando lo que se conoce como dímero. Cada "paquete" dimérico presenta dos "caras" para interactuar con dos moléculas diana. Los investigadores plantearon la hipótesis de que las dos caras se unirían a dos proteínas diana separadas, bloqueando las cuatro en un complejo y bloqueando la acción de las dianas. "Pero necesitábamos una prueba de principio", dice Jayanta Chatterjee, profesora asociada de la Unidad de Biofísica Molecular (MBU), IISc, y autora principal del estudio. El equipo decidió probar su hipótesis utilizando una de las miniproteínas llamada SIH-5 para detectar la interacción entre la proteína Spike (S) del SARS-CoV-2 y la proteína ACE2 en células humanas.
La proteína S es un trímero, un complejo de tres polipéptidos idénticos. Cada polipéptido contiene un dominio de unión al receptor (RBD) que se une al receptor ACE2 en la superficie de la célula huésped. Esta interacción facilita la entrada viral en la célula.
La miniproteína SIH-5 se diseñó para bloquear la unión del RBD a la ACE2 humana. Cuando un dímero SIH-5 encontró una proteína S, una de sus caras se unió fuertemente a uno de los tres RBD en el trímero de proteína S y la otra cara se unió a un RBD de una proteína S diferente. Este "entrecruzamiento" permitió que la miniproteína bloqueara ambas proteínas S al mismo tiempo. "Varios monómeros pueden bloquear sus objetivos", dice Chatterjee. "[Pero] el entrecruzamiento de las proteínas S bloquea su acción con mucha más eficacia. Esto se denomina efecto de avidez".
Bajo crio-EM, las proteínas S dirigidas por SIH-5 parecían estar unidas cabeza con cabeza. "Esperábamos ver un complejo de un trímero de punta con péptidos SIH-5. Pero vi una estructura que era mucho más alargada", dice Somnath Dutta, profesor asistente en MBU y uno de los autores correspondientes. Dutta y los demás se dieron cuenta de que las proteínas espigas se veían obligadas a formar dímeros y se agrupaban en complejos con la miniproteína. Este tipo de agrupamiento puede inactivar simultáneamente múltiples proteínas de punta del mismo virus e incluso múltiples partículas de virus. "He trabajado antes con anticuerpos generados contra la proteína de pico y los observé bajo crio-EM. Pero nunca crearon dímeros de los picos", dice Dutta.
También se descubrió que la miniproteína es termoestable:se puede almacenar durante meses a temperatura ambiente sin deteriorarse.
El siguiente paso fue preguntar si SIH-5 sería útil para prevenir la infección por COVID-19.
Para responder a esto, el equipo primero probó la toxicidad de la miniproteína en células de mamíferos en el laboratorio y descubrió que era segura. A continuación, en experimentos realizados en el laboratorio de Raghavan Varadarajan, profesor de MBU, se administró la miniproteína a los hámsteres, seguido de exposición al SARS-CoV-2. Estos animales no mostraron pérdida de peso y tenían una carga viral muy reducida, así como mucho menos daño celular en los pulmones, en comparación con los hámsteres expuestos solo al virus.
Los investigadores creen que con modificaciones menores y la ingeniería de péptidos, esta miniproteína fabricada en laboratorio también podría inhibir otras interacciones proteína-proteína. Diseño de inhibidores peptídicos para posibles tratamientos de la COVID-19