Investigadores de la Universidad de Ciencias de Tokio han desarrollado nuevos híbridos de péptidos complejos, que pueden inducir un tipo de muerte celular programada llamada "paraptosis" en células cancerosas resistentes a la apoptosis. Crédito:Universidad de Ciencias de Tokio
La apoptosis, un tipo de muerte celular programada (PCD), es un proceso biológico a través del cual se eliminan las células no deseadas en los organismos multicelulares. En la mayoría de las células, ciertas proteínas conocidas como "caspasas" desencadenan la apoptosis. Este proceso es especialmente importante para el tratamiento del cáncer, ya que inducir la muerte celular en las células cancerosas puede ayudar a su eliminación.
Además de la apoptosis, se producen varios tipos de PCD en las células, como paraptosis, necroptosis y autofagia. De estos, la paraptosis es el tipo de PCD identificado más recientemente, que es causado por la entrada de exceso de calcio en las células, lo que lleva a la muerte celular.
Las células cancerosas a menudo se vuelven resistentes a los medicamentos que inducen la apoptosis y otros tipos de PCD. En tales casos, la inducción de paraptosis, que no depende de caspasas, podría actuar como un tratamiento anticancerígeno prometedor. Por lo tanto, el desarrollo de compuestos que puedan inducir paraptosis en células cancerosas es crucial.
Con este fin, un equipo de investigadores de la Universidad de Ciencias de Tokio, dirigido por el Prof. Shin Aoki en colaboración con el Sr. Kohei Yamaguchi y el Dr. Kenta Yokoi, realizó un estudio para desarrollar nuevos híbridos de péptidos complejos con potencial inductor de paraptosis. Este estudio fue publicado en Bioconjugate Chemistry .
"Anteriormente, sintetizamos un compuesto híbrido de péptido complejo de iridio y observamos que inducía la muerte celular en las células cancerosas, que era diferente de la apoptosis. Dado que este compuesto era diferente a otros compuestos inductores de paraptosis, queríamos comprender su mecanismo de inducción de paraptosis. Nuestro objetivo ahora es sintetizar nuevos compuestos y dilucidar cómo inducen la paraptosis en las células, antes de compartir esta información crucial con el público", explica el profesor Aoki mientras analiza la motivación del equipo detrás de este estudio.
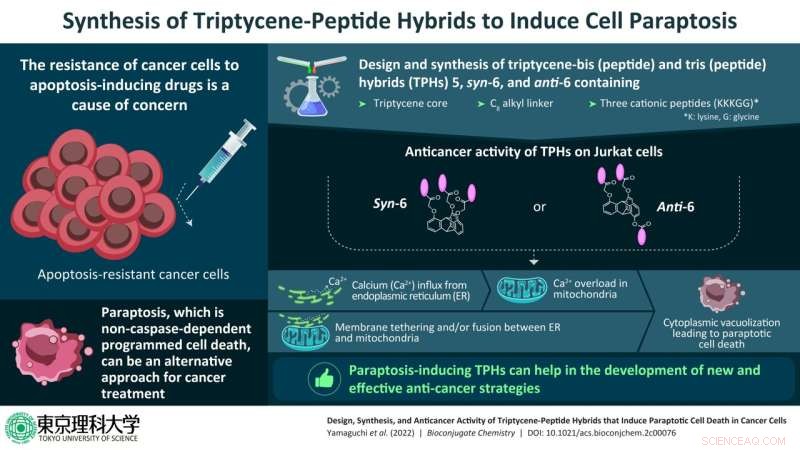
Los compuestos recién sintetizados estaban formados por un núcleo de tripticeno, un hidrocarburo aromático, con dos o tres péptidos catiónicos hechos de los aminoácidos lisina y glicina (representados como KKKGG) a través de un C8 cadena conectora de alquilo, en diferentes posiciones de las unidades de tripticeno. Como resultado, se produjeron tres híbridos de núcleo de tripticeno (TPH):5, syn-6 y anti-6.
Posteriormente, el equipo realizó experimentos en células Jurkat, un tipo de linfocitos humanos inmortalizados que se utilizan en la investigación, para comprender el tipo de PCD que se produjo en estas células en tratamiento con syn-6 y anti-6. Encontraron que la muerte en estas células fue inhibida por el cianuro de carbonilo m-clorofenil hidrazona (CCCP) que es un reactivo de desacoplamiento y un inhibidor de la absorción de calcio mitocondrial, RuRed, que es un inhibidor del canal de calcio mitocondrial) y borato de 2-aminoetoxidifenilo (2-APB), que es un inhibidor del receptor D-inositol-1,4,5-trifosfato. Sin embargo, la muerte celular no fue inhibida por los inhibidores de los otros tipos de PCD.
Por lo tanto, descartaron la autofagia, la necroptosis y la apoptosis, lo que confirma que la paraptosis es una vía importante de PCD inducida por syn-6 y anti-6 en las células Jurkat.
"Los estudios han indicado que los TPH syn-6 y anti-6 inducen la transferencia del exceso de calcio desde el retículo endoplásmico (ER) a las mitocondrias, lo que resulta en una pérdida del potencial de la membrana mitocondrial. Es muy probable que estos fenómenos estén fuertemente relacionados con la fusión del RE con la mitocondria, seguida de vacuolización citoplasmática, lo que resulta en la muerte celular", dijo el profesor Aoki, cuando se le preguntó por qué se seleccionaron estos dos TPH para el estudio. Los TPH syn-6 y anti-6 son más hidrofílicos que otros TPH, lo que también podría ser una razón de su alto potencial anticancerígeno inductor de paraptosis.
A través de experimentos de imágenes adicionales, el equipo detectó la presencia de vacuolización citoplasmática, concentraciones elevadas de calcio mitocondrial y la degradación del RE en células Jurkat tratadas con syn-6 y anti-6.
Sobre la base de hallazgos anteriores, el equipo planteó la hipótesis de que también en las células Jurkat, la entrada de calcio en las mitocondrias podría verse facilitada por la proximidad del RE y las mitocondrias. Como era de esperar, descubrieron que el RE y las membranas mitocondriales estaban unidas entre sí, lo que facilitaba la transferencia directa de calcio.
Estos hallazgos confirmaron que las células Jurkat tratadas con syn-6 y anti-6 habían sufrido muerte celular programada, debido a la paraptosis. También brindan información crucial para el diseño de compuestos que pueden usarse como agentes terapéuticos contra el cáncer y otras enfermedades. Un metalopéptido ataca e interrumpe la función mitocondrial en las células madre del cáncer de mama