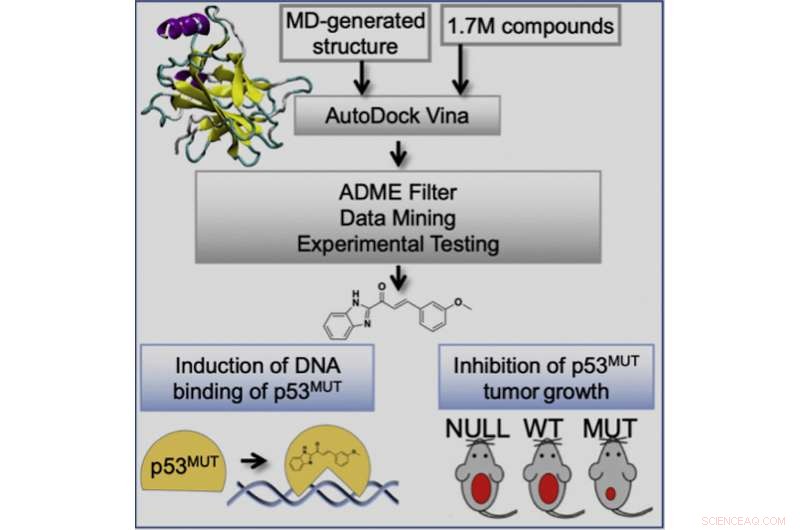
Gráficamente abstracto. Crédito:Geetha Durairaj et al, Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.07.003
Un nuevo estudio, dirigido por investigadores de la Universidad de California, Irvine y la Universidad de California, San Diego, revela un nuevo enfoque guiado por computación para identificar moléculas pequeñas que pueden restaurar aspectos de la función de supresión de tumores p53 de tipo salvaje a p53 mutado, que juegan un papel importante en muchos cánceres humanos. Este enfoque tuvo éxito tanto in vitro como in vivo. Esta estrategia puede aumentar la diversidad química de las moléculas correctoras de p53 para el desarrollo clínico.
El supresor de tumores p53 es uno de los mecanismos más potentes que utilizan los organismos para protegerse del cáncer. Los elefantes tienen múltiples copias del gen p53 y rara vez desarrollan cáncer. Los humanos tienen solo una copia y es el gen más mutado que se encuentra en el cáncer humano. Se buscan activamente diversos enfoques terapéuticos para atacar esta vía.
"Curiosamente, una gran fracción de las alteraciones de p53 son mutaciones sin sentido, donde el código genético de p53 se altera de una manera que produce un aminoácido diferente al que produciría normalmente", explicó Peter Kaiser, Ph.D., profesor y presidente de Departamento de Química Biológica de la Facultad de Medicina de la UCI. "Esto da como resultado una abundancia de niveles de proteína p53 mutante en tumores que, en principio, son susceptibles de un enfoque de fármaco corrector".
Publicado en Biología Química Celular , el estudio identificó pequeños compuestos similares a fármacos que actúan a través de un modo de acción bien definido; no requieren unión covalente, inducción de desequilibrio redox o unión de metal; y tienen actividades anticancerígenas selectivas en tumores con mutaciones sin sentido de p53. Esta investigación proporciona un marco para el descubrimiento de compuestos de reactivación de p53 que pueden ayudar a aumentar la diversidad química y mejorar las propiedades farmacológicas necesarias para la traducción de la reactivación farmacéutica mutante de p53 a la clínica.
"Este estudio demuestra con éxito la viabilidad y eficacia de la reactivación farmacéutica de p53 mutante", dijo Kaiser. "Estos hallazgos son alentadores dada la gran cantidad de pacientes de cáncer con mutaciones de p53 que podrían beneficiarse de tales medicamentos".
Este estudio involucró la aplicación de un enfoque de detección virtual basado en conjuntos, desarrollado en el laboratorio de Rommie Amaro, profesora y jefa del Departamento de Química y Bioquímica de UC San Diego, que tiene el potencial de identificar compuestos con un mayor potencial para matar el cáncer. y con un amplio espectro de actividad en un panel de mutantes de p53. Los investigadores demostraron que sus compuestos se unen a p53 mutante y cambian la conformación de p53 mutante a estructuras de tipo salvaje. Esto restaura la actividad de unión al ADN de p53 para activar la respuesta transcripcional de p53, que a su vez previene la progresión tumoral en modelos de ratón de forma selectiva para tumores con una mutación sin sentido de p53.
Aún quedan desafíos para definir los mecanismos exactos y desarrollar fármacos correctores altamente activos para p53 mutado y se necesitan experimentos futuros para optimizar las propiedades farmacológicas para avanzar hacia la terapéutica clínica. Se necesita más de una copia mutante del gen PIK3CA para que el cáncer de mama sea más agresivo