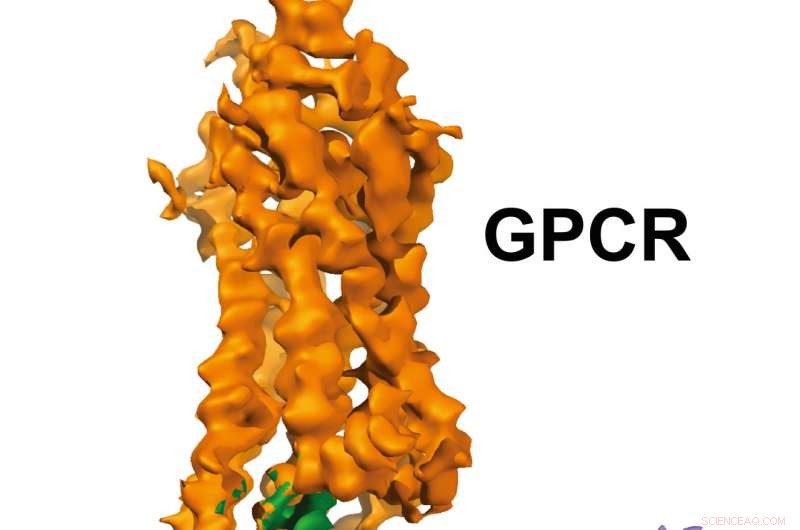
Estructura de GPCR-Gi. Crédito:Laboratorio Xu, Instituto de Investigación Van Andel
Por primera vez, Los científicos han visualizado la interacción entre dos componentes críticos de la vasta red de comunicación celular del cuerpo, un descubrimiento que podría conducir a medicamentos más efectivos con menos efectos secundarios para afecciones que van desde la migraña hasta el cáncer.
Las imágenes de resolución casi atómica, publicado hoy en Naturaleza , muestran un receptor acoplado a proteína G (GPCR) llamado rodopsina unido a una proteína G inhibidora, y proporciona un modelo para diseñar de forma más precisa, medicamentos selectivos al mismo tiempo que resuelve un problema de larga data en el campo.
"Visualizar este complejo resuelve un capítulo perdido en la historia de GPCR al revelar finalmente cómo estas dos moléculas interactúan con exquisito detalle, "dijo H. Eric Xu, Doctor., profesor del Instituto de Investigación Van Andel (VARI) y uno de los autores principales del estudio. "Todo en biología se basa en interacciones moleculares, por lo que cuanto más sepamos sobre cómo funcionan juntas las estructuras de estas dos moléculas, la mejor posición en la que estamos para diseñar medicamentos mejorados con menos efectos no deseados ".
Los hallazgos de hoy fueron posibles gracias al uso de una técnica revolucionaria llamada microscopía crioelectrónica (cryo-EM), lo que permite a los científicos ver moléculas difíciles de visualizar con sorprendente claridad.
"El uso de la tecnología crio-EM para obtener información estructural sobre objetivos farmacéuticos importantes como los GPCR en varios estados demuestra que ahora estamos en condiciones de aplicar estos métodos para aplicaciones de descubrimiento de fármacos, "dijo Sriram Subramaniam, Doctor., investigador del Instituto Nacional del Cáncer de los Institutos Nacionales de Salud y autor principal del estudio.
Incrustado en la membrana celular, Los GPCR actúan como conductos entre una célula y su entorno, interactuar con proteínas G y otras moléculas de señalización llamadas arrestinas para transmitir mensajes importantes hacia y desde la célula que regulan una gama de funciones fisiológicas, incluido el crecimiento, respuestas inmunes y percepción sensorial.
Cuando se vincula con GPCR, Las proteínas G inhibidoras regulan la producción de mensajeros químicos secundarios que tienen efectos en todo el cuerpo. de las interacciones con los receptores de serotonina en el cerebro y el intestino, que ayudan a regular el estado de ánimo y el apetito, a las interacciones con los receptores de dopamina en el cerebro, que controlan las respuestas de recompensa y el movimiento voluntario, Entre muchos otros.
Estas interacciones de amplio alcance con proteínas G y arrestinas, junto con su accesibilidad en el exterior de la celda, hacen que los GPCR sean objetivos atractivos para el desarrollo terapéutico. En la actualidad, más del 30 por ciento de los medicamentos en el mercado funcionan al interactuar con los GPCR.
"La información revelada por nuestros hallazgos ayudará a facilitar el diseño de una nueva generación de medicamentos, "dijo Yanyong Kang, Doctor., un científico investigador en el Laboratorio Xu y co-primer autor del estudio. "Debido a que este es el primer complejo de proteína G inhibidora de GPCR que se determina estructuralmente, Creemos que nuestros métodos ayudarán a llevar a la caracterización de otros importantes, pero GPCR difíciles de visualizar ".
Las imágenes tridimensionales generadas por el equipo revelan una hélice especializada al final de la proteína G inhibitoria que actúa como firma estructural. que ayuda a los GPCR como la rodopsina a diferenciar entre las proteínas G inhibitorias y otro tipo de proteína G conocida como proteína G estimulante.
Los hallazgos de hoy son los últimos de una serie de novedades para Xu y su equipo, que incluyen un hito 2015 Naturaleza estudio que describió por primera vez la estructura de la rodopsina y la arrestina en conjunto. Este trabajo, que fue aclamado como un gran avance en el campo, le ganó a Xu el premio Hans Neurath de The Protein Society y la Fundación Hans Neurath en 2016.
En un estudio de seguimiento publicado en Celda en 2017, Xu y sus colaboradores refinaron aún más su estructura anterior del complejo rodopsina-arrestina, y reveló un conjunto de códigos de fosforilación que dictan el ensamblaje de complejos GPCR-arrestina.
Los GPCR son notoriamente difíciles de visualizar utilizando métodos tradicionales de cristalografía de rayos X; hasta la fecha, solo 40 de más de 800 GPCR totales han tenido sus estructuras determinadas, incluido el complejo rodopsina-arrestina de Xu.
Para determinar la estructura actual, el equipo aprovechó el microscopio crioelectrónico Titan Krios de alta potencia de VARI, que es capaz de obtener imágenes de moléculas 1/10, 000th del ancho de un cabello humano y puede visualizar más fácilmente moléculas como GPCR que están incrustadas en la membrana celular. Krios del Instituto, que forma parte de su suite de microscopía crioelectrónica avanzada David Van Andel, es uno de los menos de 120 microscopios de este tipo en el mundo.
Subramaniam y su equipo han sido pioneros en el uso de cryo-EM para determinar algunas de las estructuras de mayor resolución reportadas hasta ahora usando cryo-EM. incluyendo varios complejos ligando-proteína clínicamente relevantes.