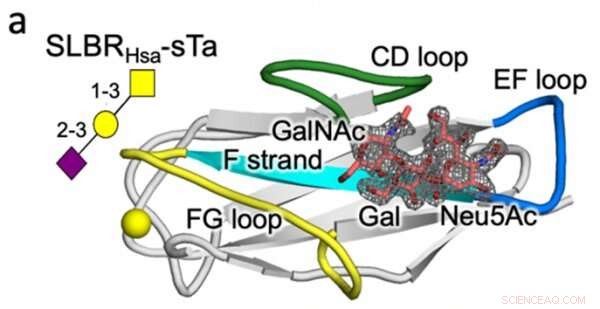
Estructura cristalina de un estreptococo SLBR (Hsa) que se une con alta afinidad al receptor de glucano de la célula huésped (sTa). Se predice que la variación en la secuencia y estructura de los bucles de proteína SLBR marcados (CD, EF y FG) controlará la selectividad de unión al receptor. Crédito:Universidad de Vanderbilt
Las bacterias en nuestro cuerpo se unen a varios receptores de la superficie de la célula huésped, lo que determina dónde viven las bacterias y cómo se comportan. Estos receptores, formados por cadenas de moléculas de azúcar llamadas glicanos, son más de lo que parece. Las células que existen en estados patológicos progresivos como el cáncer pueden tener un mayor número de receptores de glucano en sus superficies.
El laboratorio de Tina Iverson, presidente de la cátedra Louise B. McGavock y profesora de farmacología, descubrió el mecanismo estructural por el cual la bacteria estreptococo se une a los glicanos de la célula huésped, abriendo la puerta a nuevas formas de usar moléculas bacterianas para detectar potencialmente células cancerosas.
Investigaciones anteriores han demostrado que bacterias como los estreptococos usan moléculas adhesivas llamadas SLBR para unirse a los receptores de glucano en la superficie de las células huésped. El laboratorio de Iverson planteó la hipótesis de que estas bacterias pueden adaptar la estructura de sus SLBR para unirse a una amplia gama de receptores de glucanos del huésped para ayudarlos a habitar nuevos nichos en el cuerpo.
Volviendo a la ingeniería de proteínas, el laboratorio de Iverson determinó qué elementos estructurales SLBR controlan la elección de la unión del receptor de la célula huésped. Al modificar artificialmente el ADN que codifica los SLBR y purificar las proteínas resultantes de las bacterias, descubrieron que tres bucles en el SLBR, llamados CD, EF y FG, controlan a qué glicanos se unirá la bacteria.
La unión bacteriana a los receptores de la célula huésped es el primer paso en la infección. Comprender el mecanismo detrás de este proceso también puede ayudar a los investigadores a identificar células enriquecidas en glicanos superficiales que existen dentro de los estados de enfermedad.
Como parte de este estudio, el laboratorio de Iverson encontró que las bacterias comensales de la boca se unen a una proteína glicosilada o recubierta de azúcar de la boca que también está sobrerrepresentada en las células cancerosas altamente agresivas en la mayoría de los carcinomas. Mediante el desarrollo de técnicas que alteran la selectividad de los glicanos SLBR, Iverson está decidido a abordar un nuevo objetivo a largo plazo:desarrollar reactivos que puedan identificar cánceres altamente agresivos. Los glucanos que expresan las células pueden servir como biomarcadores para ayudar a los médicos a detectar enfermedades para la intervención terapéutica.
"Estamos trabajando para expandir una biblioteca de agentes de unión a glicanos que desarrollamos en este estudio para permitirnos detectar una mayor variedad de glicanos", dijo Iverson, también profesor de bioquímica. "Eventualmente nos gustaría convertirlo en kits de diagnóstico".
El estudio "Origins of glycan selectivity in streptococcal Siglec-like adhesins sugirió mecanismos de adaptación del receptor" se publicó en Nature Communications en mayo de 2022. + Explora más