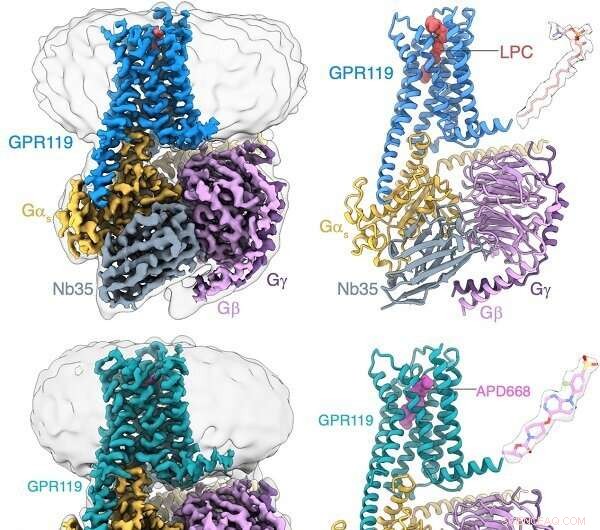
Identificación de la LPC unida al complejo GPR119-Gs por crio-EM. Crédito:Peiyu Xu del laboratorio de H. Eric Xu
Las enfermedades metabólicas, como la diabetes, el hígado graso y la obesidad, se han convertido en un importante "asesino" que afecta a la salud humana. Los estudios han demostrado que algunos receptores huérfanos podrían ser dianas para el tratamiento de estas enfermedades. GPR119, también conocido como receptor insulinotrópico dependiente de glucosa, es un receptor huérfano en la superfamilia de receptores acoplados a proteína G (GPCR). La activación de GPR119 puede estimular la secreción de péptido-1 similar al glucagón (GLP-1) y polipéptido liberador de insulina (GIP) dependiente de glucosa, dos hormonas que son importantes para regular el equilibrio del metabolismo de la glucosa en el cuerpo.
GPR119 se considera un posible objetivo farmacológico para el tratamiento de la diabetes, el hígado graso, la obesidad y otras enfermedades metabólicas. En los últimos años, los farmacólogos han desarrollado numerosos agonistas de molécula pequeña de GPR119. Sin embargo, el descubrimiento de fármacos de GPR119 está limitado por la falta de comprensión estructural del reconocimiento de ligandos para el receptor.
En un estudio publicado en Nature Structural &Molecular Biology , un equipo de investigadores dirigido por H. Eric Xu (Xu Huaqiang) y Xie Xin del Instituto de Materia Médica de Shanghai (SIMM) de la Academia de Ciencias de China, y Jiang Yi del Laboratorio Lingang, proporcionó información estructural sobre la unión de GPR119 al ligando endógeno lisofosfatidilcolinas (LPC) y al fármaco candidato APD668.
Mediante estudios de biología estructural, bioquímica y funcionales, los investigadores identificaron que GPR119 podría unirse preferentemente al ligando endógeno LPC. El análisis estructural reveló que el bolsillo de unión al ligando de GPR119 consistía en un bolsillo hidrofóbico y un bolsillo hidrofílico. En particular, se formó una abertura en la parte central del dominio transmembrana, que fue una característica única de otros GPCR y proporcionó un espacio de unión favorable para LPC y otro sitio de entrada potencial para los ligandos.
Estudios adicionales sobre la estructura de GPR119 en complejo con APD668, un candidato a fármaco para el tratamiento de la diabetes, revelaron que la estructura rígida de APD668 formaba interacciones potentes con el bolsillo hidrofóbico de GPR119. La alta resolución de la estructura reveló el "interruptor de palanca", residuos importantes para cambiar la activación de los GPCR. GPR119 exhibió un modo de desviación único de otros GPCR durante la activación del receptor. Se observó que una molécula de agua formaba enlaces de hidrógeno con residuos para estabilizar el estado activado de GPR119. Además, el análisis estructural reveló el modo de reconocimiento único de GPR119 a la proteína Gs de la molécula de señalización corriente abajo.
Este estudio descubrió el mecanismo molecular de la unión del ligando, la activación del receptor y el acoplamiento de la proteína G del receptor huérfano GPR119, y proporcionó plantillas estructurales e información sobre el desarrollo de nuevos fármacos dirigidos a GPR119 para el tratamiento de enfermedades metabólicas. Un receptor acoplado a proteína G puede ser un objetivo farmacológico para la enfermedad del hígado graso no alcohólico