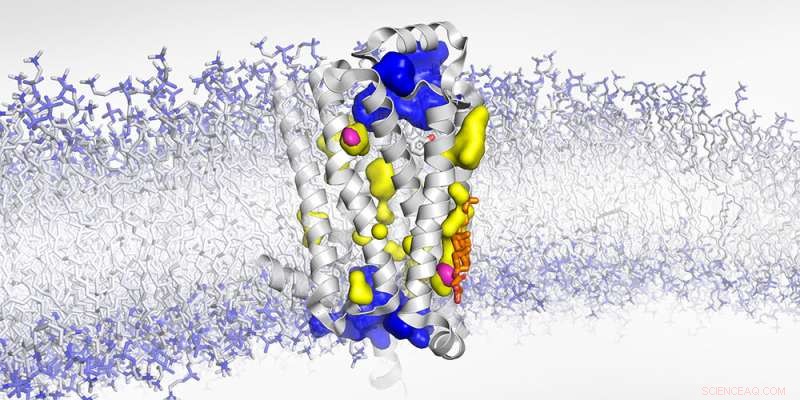
Estructura del receptor adrenérgico β1 unido a la membrana con cavidades expuestas al agua (azul), no accesibles al agua (amarillo) y vacíos secos (magenta). Crédito:Biozentrum, Universidad de Basilea
Casi todas las funciones vitales del cuerpo humano están reguladas por los llamados receptores acoplados a proteína G en la superficie celular. Estos receptores sirven así como dianas farmacológicas atractivas para tratar diversas enfermedades. Los investigadores ahora han descubierto que los espacios vacíos dentro de estos receptores son importantes para su activación y, por lo tanto, para transmitir mensajes a la célula interna. Su enfoque para localizar estos vacíos puede ayudar a dirigir la búsqueda de nuevos fármacos.
Los receptores acoplados a proteínas G (GPCR) nos permiten ver, saborear alimentos, sentir frío o calor o responder al estrés, entre otras cosas. Ubicados en la superficie celular, los GPCR detectan una gran variedad de señales, como nutrientes, luz, olores u hormonas. Al cambiar su conformación, transmiten esta información desde el exterior hacia el interior de la célula. El conocimiento acumulado sobre los GPCR ha afectado enormemente a la medicina moderna:alrededor de un tercio de todos los medicamentos comercializados se dirigen a los GPCR.
Los espacios vacíos son importantes para la activación de los receptores
Usando tecnología de punta, el equipo de investigación dirigido por el Prof. Stephan Grzesiek, junto con colaboradores del Biozentrum de la Universidad de Basilea y el Instituto Paul Scherrer, ha descubierto que los GPCR contienen cavidades completamente vacías que son importantes para su activación. Su reciente enfoque experimental, publicado en Nature Chemistry , puede dirigir y acelerar la búsqueda de candidatos a fármacos nuevos y más específicos con menos efectos secundarios.
Aunque los 826 GPCR dentro del cuerpo humano responden a muchos estímulos diferentes, todos comparten una arquitectura común. "Nuestro objetivo es comprender a nivel atómico cómo los GPCR transmiten señales", dice la Dra. Layara Abiko, quien codirigió el estudio. "Durante muchos años, por lo tanto, hemos estado estudiando el receptor β1-adrenérgico, un GPCR que prepara el cuerpo para la lucha o la huida". La hormona adrenalina se une al receptor y lo activa, lo que desencadena una respuesta de estrés, por ejemplo, provocando un aumento de la frecuencia cardíaca y la presión arterial. Los betabloqueantes inhiben este receptor y, por lo tanto, son fármacos eficaces para tratar la hipertensión o las enfermedades cardiovasculares.
Localización exacta de vacíos secos
"Gracias a la RMN de alta presión y nuestro enfoque experimental que utiliza la dispersión de rayos X en cristales receptores que incorporaron el gas noble xenón, pudimos completar aún más la imagen de este receptor altamente dinámico", dice Abiko. "Anteriormente, se suponía que las cavidades dentro del receptor estaban llenas de agua. Ahora hemos revelado que algunas de ellas están vacías". Durante la activación, la conformación del receptor cambia de tal manera que estos vacíos secos se comprimen y desaparecen. En consecuencia, el receptor se encoge como cuando aprietas una esponja. En el caso del receptor β1-adrenérgico, este cambio conformacional es clave para iniciar la respuesta de lucha o huida del cuerpo.
Los investigadores ahora han podido localizar exactamente dos de esas cavidades vacías y revelaron que el colesterol, un componente importante de la membrana celular, puede llenar una de ellas. Como una cuña, el colesterol impide que el receptor apriete y cambie a su estado completamente activo. "Bloquear este vacío obstruye los movimientos sutiles pero esenciales necesarios para activar el GPCR", explica Abiko. "Creemos que este efecto de cuña podría ser otra capa de regulación del receptor".
Nuevas rutas para el desarrollo de fármacos
Pero, ¿por qué puede ser importante la búsqueda de vacíos secos? Los sitios de unión de fármacos clásicos a menudo son similares entre las subclases de GPCR. Un fármaco dirigido a tal sitio puede unirse a más de un receptor y, por lo tanto, causar efectos secundarios no deseados. Por el contrario, las cavidades secas difieren considerablemente entre los GPCR, incluso cuando son de la misma subclase. Esto los convierte en objetivos farmacológicos altamente selectivos.
"De esta manera, puede diseñar fármacos que sean altamente específicos para un receptor", explica Abiko. El nuevo enfoque desarrollado puede localizar tales sitios de unión a fármacos no convencionales que difieren mucho entre los receptores. Esto puede ayudar al proceso de selección de nuevas terapias, ahorrar tiempo y reducir costos. Explorando los límites de los receptores acoplados a proteína G