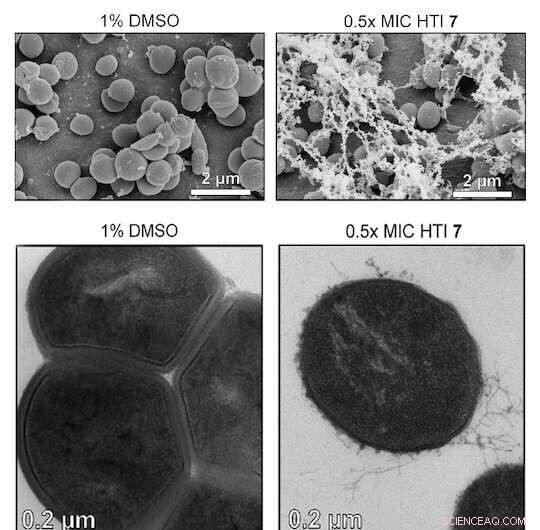
Crédito:Ciencia avanzada (2022). DOI:10.1002/advs.202203242
Una nueva clase de moléculas motorizadas que matan bacterias específicas se muestra prometedora para frenar la amenaza de la resistencia a los antibióticos para la salud humana.
Científicos de la Universidad de Rice lideraron un equipo que desarrolló moléculas de hemitioíndigo (HTI) activadas por luz que destruyen las bacterias Gram-positivas y las biopelículas que forman. Las moléculas lo hacen mejorando la generación local de especies reactivas de oxígeno (ROS) que atacan químicamente y destruyen las células resistentes a los medicamentos.
Las nuevas moléculas difieren y son complementarias de otras creadas en Rice que también se activan con la luz pero perforan las membranas celulares para matarlas.
Al igual que los ejercicios basados en el trabajo ganador del Premio Nobel de Bernard Feringa, las moléculas basadas en HTI se activan con la luz visible en lugar de la dañina radiación ultravioleta.
Ambos son productos del químico de Rice James Tour y sus colegas. La exalumna de Rice Ana Santos, becaria global postdoctoral en el Instituto de Investigación de la Salud de las Islas Baleares en Palma, España, y Alexis van Venrooy, ahora científico principal en Genesis Therapeutics, San Diego, son coautores principales del nuevo estudio en Ciencia avanzada .
Las máquinas moleculares basadas en HTI constan de dos mitades:una unidad de tioíndigo unida a un carbociclo a través de un doble enlace de carbono central. Cuando se activa con la luz visible, la molécula sufre un cambio de conformación que da como resultado un movimiento de 360 grados similar a un taladro o un cambio entre dos conformaciones, como un interruptor de "encendido/apagado", según el diseño molecular.
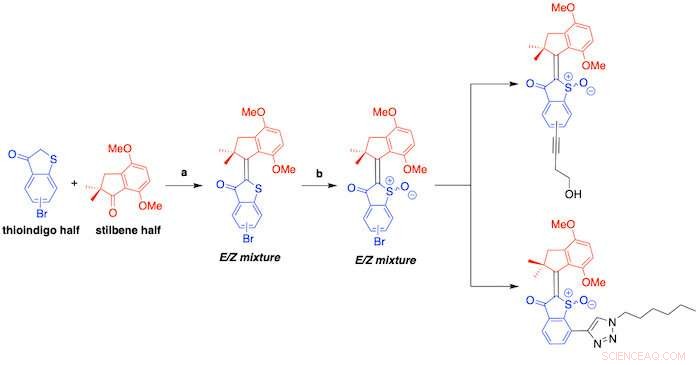
Un esquema muestra la síntesis de hemitioíndigos descrita en un nuevo estudio dirigido por investigadores de Rice. Los motores moleculares se activan con la luz visible y matan las bacterias dañinas al generar especies reactivas de oxígeno. Crédito:Tour Group
En el proceso, los HTI activados reaccionan con la célula y el oxígeno molecular, transfiriendo electrones para producir ROS que golpean las células objetivo.
"Estos no están matando células al rasgar mecánicamente las membranas como lo hacen los anteriores", dijo Tour. "Inducen suficiente alteración como para que se generen especies reactivas de oxígeno y radicales libres y terminen matando las células.
"Así que no es la muerte necrótica rápida que vimos antes", dijo. "Es un poco más lento, pero extremadamente eficiente".
“Una ventaja importante de estas moléculas es que tienen un espectro de actividad estrecho y matan selectivamente a un grupo específico de bacterias, las bacterias Gram-positivas”, dijo Santos. "Por lo tanto, es menos probable que causen los efectos secundarios observados con los antibióticos de amplio espectro que matan indiscriminadamente tanto a las bacterias 'buenas' como a las 'malas', y también es menos probable que generen resistencia porque solo un grupo de bacterias se ve afectado. "
Las bacterias grampositivas carecen de una membrana externa (aunque tienen una capa gruesa de peptidoglicano), y esto parece hacerlas más susceptibles a las ROS que se oxidan y rompen sus paredes celulares.
Los investigadores probaron varias variantes de HTI en siete cepas de bacterias Gram-positivas y descubrieron que la molécula las eliminaba a todas en presencia de luz. (Los HTI fueron menos efectivos en las bacterias Gram-negativas, presumiblemente porque su doble membrana evita que el HTI ingrese a la célula. Pero permeabilizarlos con una solución tampón Tris-EDTA hizo que fuera más probable que los HTI los eliminaran).
También expusieron colonias de Staphylococcus aureus con y sin la presencia de carroñeros de ROS y encontraron que aquellas con los carroñeros redujeron la eficacia de las moléculas de hemitioíndigo. Sin carroñeros, las ROS tenían el efecto deseado sobre las bacterias.
El estudio mostró que los HTI también mataron a las células persistentes tolerantes a los antibióticos de diferentes cepas Gram-positivas en tan solo 25 minutos, más rápido que los antibióticos convencionales. En todos los casos, la exposición repetida a HTI no aumentó la resistencia de las bacterias al tratamiento.
Debido a que el tratamiento se basa en ROS en lugar de la acción mecánica, no daña las células de los mamíferos, dijo Santos. "Esto allana el camino para una nueva terapia antimicrobiana que puede dirigirse de forma segura a los patógenos grampositivos asociados con infecciones de la piel, como heridas por quemaduras", dijo.
"Los resultados también ayudan a profundizar nuestra comprensión de las máquinas moleculares en general al mostrar que no todas actúan por los mismos mecanismos y que las diferencias en el núcleo químico de la molécula pueden dar lugar a acciones biológicas muy diferentes". Los nanotaladros que matan bacterias se actualizan:la luz visible activa máquinas moleculares para tratar infecciones