
Desempeñaron un papel clave en la demostración del comportamiento inusual del carbono:Tim Schleif (izquierda) y Joel Mieres Pérez (derecha). Crédito:RUB, Marquard
Los químicos de la Ruhr-Universität Bochum han encontrado evidencia de que los átomos de carbono no solo se comportan como partículas, sino también como ondas. Esta propiedad de la mecánica cuántica es bien conocida para las partículas ligeras como los electrones o los átomos de hidrógeno. Sin embargo, Los investigadores sólo en raras ocasiones han observado la dualidad onda-partícula para átomos pesados, como el carbono. El equipo dirigido por el Prof. Dr. Wolfram Sander y Tim Schleif de la Cátedra de Química Orgánica II junto con el Prof. Dr. Weston Thatcher Borden, Universidad del Norte de Texas, informes en la revista Angewandte Chemie .
"Nuestro resultado es uno de los pocos ejemplos que muestran que los átomos de carbono pueden mostrar efectos cuánticos, "dice Sander. Específicamente, los investigadores observaron que los átomos de carbono pueden hacer túneles. Superan así una barrera energética, aunque en realidad no poseen suficiente energía para hacer eso.
Rara vez observado para partículas pesadas
Wolfram Sander explica la paradoja:"Es como si un tigre hubiera salido de su jaula sin saltar la valla, que es demasiado alto para él. Pero todavía sale. "Esto solo es posible si se comporta como una ola, pero no si se comporta como una partícula. La probabilidad de que un objeto pueda hacer un túnel depende de su masa. El fenómeno puede, por ejemplo, observarse mucho más fácilmente para los electrones ligeros que para los átomos de carbono relativamente pesados.
Los investigadores investigaron la reacción del túnel utilizando el reordenamiento de Cope, una reacción química que se conoce desde hace casi 80 años. El material de partida para la reacción, un compuesto de hidrocarburo, es idéntica a la molécula del producto. Por tanto, el mismo compuesto químico existe antes y después de la reacción. Sin embargo, los enlaces entre los átomos de carbono cambian durante el proceso.
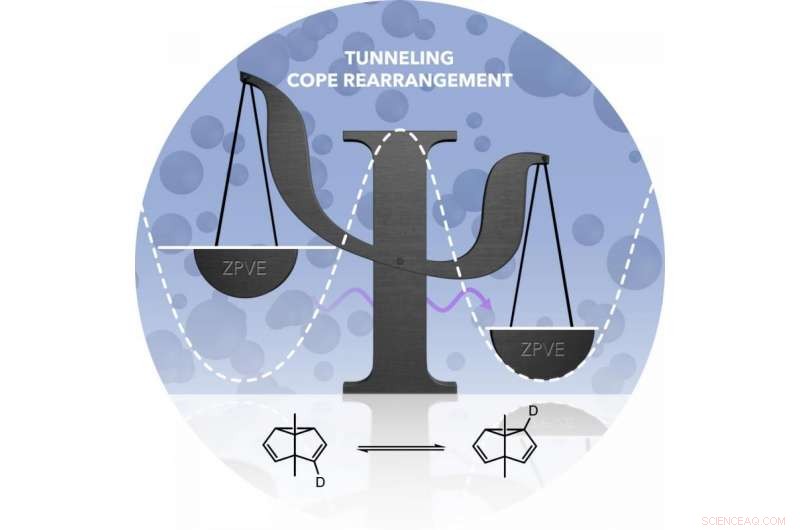
La transposición de Cope da como resultado un producto que es idéntico al material de partida. Sin embargo, ambas formas tienen energías diferentes. La barrera de energía para la reordenación (simbolizada por la línea de puntos) no se puede superar a bajas temperaturas. Solo cuando el átomo de carbono se comporta como una onda (flecha violeta) puede sortear la barrera. Crédito:Markus Henkel
En su experimento, los investigadores de Bochum marcaron uno de los átomos de carbono en la molécula:reemplazaron el átomo de hidrógeno unido a él con el isótopo de hidrógeno deuterio, una versión más pesada de hidrógeno. Las moléculas antes y después de la transposición de Cope diferían en términos de la distribución del deuterio. Debido a estas diferentes distribuciones, ambas formas moleculares tenían energías ligeramente diferentes.
La reacción no debería tener lugar en realidad
A temperatura ambiente, esta diferencia tiene poco efecto; debido al abundante suministro de energía térmica en el área circundante, ambas formas ocurren con la misma frecuencia. Sin embargo, a temperaturas muy bajas por debajo de diez Kelvin, Se prefiere significativamente una forma de molécula debido a la diferencia de energía. Al pasar de la temperatura ambiente a temperaturas extremadamente bajas, el equilibrio tiene que pasar de una distribución igual de ambas formas a una distribución desigual.
Esta transición no puede, sin embargo, ocurren de la manera clásica - ya que, al reorganizar de una forma a otra, hay que superar una barrera de energía, aunque la propia molécula no tiene la energía necesaria para ello y el ambiente frío tampoco puede proporcionarla. Aunque el nuevo equilibrio no debería producirse de la forma clásica, no obstante, los investigadores pudieron demostrarlo en el experimento. Su conclusión:la reordenación de Cope a temperaturas extremadamente bajas solo puede explicarse por un efecto de túnel. Por lo tanto, proporcionaron evidencia experimental para una predicción hecha por Weston Borden hace más de cinco años basada en estudios teóricos.
Los disolventes influyen en la capacidad de hacer túneles
En Ruhr-Universität, Wolfram Sander realiza investigaciones en el clúster de excelencia Ruhr Explores Solvation, donde se ocupa de las interacciones de disolventes y moléculas disueltas. "Se sabe que los disolventes influyen en la capacidad de hacer túneles, "dice el químico". Sin embargo, hasta ahora no se ha entendido cómo lo hacen ".