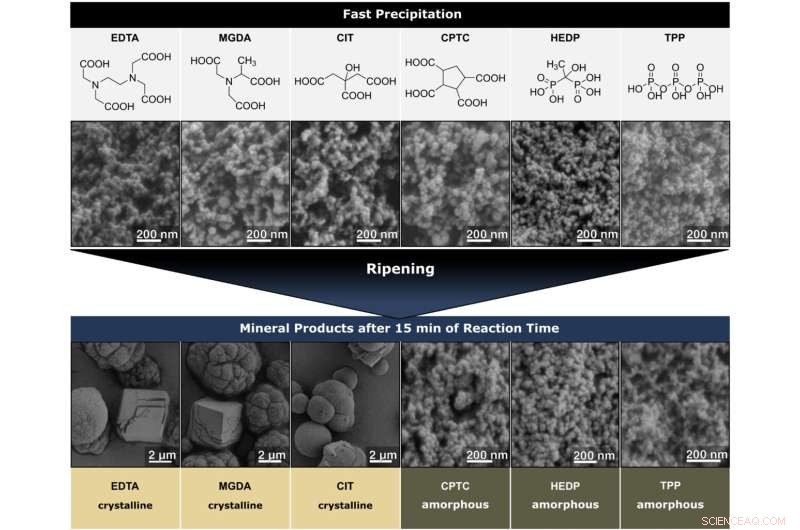
Arriba:estructuras moleculares de los aditivos de bajo peso molecular empleados. Medio:imágenes SEM de los productos después de una precipitación rápida en presencia de aditivos. Todos los polvos eran amorfos. Abajo—Productos recuperados después de 15 min de maduración. Polvos generados con EDTA, MGDA y CIT transformados en mezclas de calcita y vaterita. Solo en presencia de CPTC, HEDP y TPP, los polvos permanecieron amorfos. Crédito:Edición internacional de Angewandte Chemie (2022). DOI:10.1002/anie.202208475
Desde vasos empañados hasta depósitos en lavavajillas, la cal es un problema omnipresente. Una colaboración de investigación internacional dirigida por dos investigadores de la FAU ahora ha investigado qué sustancias podrían agregarse al detergente para lavavajillas para evitar la acumulación de cal. El conocimiento sobre los mecanismos involucrados se puede utilizar para desarrollar ingredientes más sostenibles. Los resultados han sido publicados en la revista Angewandte Chemie .
Los cristales de cal que se producen antes de la cal, como la película lechosa que queda en los vasos, se forman cuando el agua se seca y deja un residuo sólido. Se añaden fosfatos al polvo para lavavajillas para abordar este problema y evitar estos depósitos en los lavavajillas. Sin embargo, los fosfatos también son fertilizantes y tarde o temprano se transportan a los ríos y océanos a través de las aguas residuales. Allí, los fosfatos hacen que el agua sea rica en nutrientes. Esto permite que ciertos tipos de algas se reproduzcan demasiado rápido, lo que da lugar a una plaga de algas no deseada, que a su vez puede provocar la muerte masiva de otros organismos y plantas.
Para abstenerse de utilizar fosfatos en el futuro, los investigadores de la FAU dirigidos por Priv. Doz. El Dr. Stephan E. Wolf, Presidente de Glass and Ceramics, y el Prof. Dr. Dork Zahn, Profesor de Química Teórica, han investigado cómo los fosfatos y otros ingredientes comunes previenen los residuos. Han descubierto varios mecanismos. Pudieron demostrar cómo funcionan exactamente los mecanismos complejos y cómo se complementan perfectamente entre sí.
Su trabajo condujo a una sugerencia de una sustancia que funciona de manera muy similar al fosfato, pero que parece ser más amigable con el medio ambiente. La sustancia interfiere con los depósitos, haciéndolos más desorganizados e impidiendo que los cristales organizados formen paquetes estables con iones de calcio y carbonato. Esto evita los depósitos por completo o los hace más fáciles de disolver debido a su estructura desorganizada.
El equipo no solo pudo determinar qué mecanismos evitan los depósitos de cal, sino que también obtuvo nuevos conocimientos sobre cómo se forma la cal. "Descubrimos que el proceso detrás de la formación de cal es mucho más complejo de lo que imaginamos", explica el Prof. Dr. Dirk Zahn.
Los nuevos conocimientos también nos ayudan a comprender el efecto que tienen los organismos en la producción de cal en la naturaleza. Los crustáceos, por ejemplo, tienen que poder controlar la producción de cal para formar sus caparazones y asegurar su supervivencia. "Especialmente en vista del cambio climático, debemos comprender qué es particularmente perjudicial para los organismos que secretan cal, como los corales, las conchas y los gasterópodos marinos, si queremos protegerlos lo suficiente", dice el Dr. Stephan E. Wolf. Los gusanos elevan los niveles de fosfato en el césped