Gráficamente abstracto. Crédito:Biología química de la naturaleza (2022). DOI:10.1038/s41589-022-01140-1
Al igual que el Correcaminos burlando a Wile E. Coyote, el SARS-CoV-2 (el virus infeccioso responsable del COVID-19) sigue mutando, generando nuevas variantes que pueden escaparse de las garras de un sistema inmunitario bien entrenado o de un fármaco bien dirigido o vacuna.
Ahora, los científicos de Stanford Medicine han encontrado una manera de imbuir moléculas inmunes que alguna vez se consideraron inútiles con la capacidad de poner al SARS-CoV-2 en una llave de cabeza terapéutica de la que no puede zafarse. Su método se describe en un artículo publicado el 8 de septiembre en Nature Chemical Biology . El estudio fue dirigido por el biólogo y vacunólogo Peter Kim, Ph.D.
Dos cosas sobre el estudio se destacan. Primero, aunque aún no está listo para su uso en humanos, es un paso sólido hacia el desarrollo de medicamentos ampliamente efectivos que no dejan de funcionar solo porque un virus desagradable haya ideado un nuevo truco. Y en segundo lugar, un componente clave de la nueva terapia era una molécula que habitualmente se tiraba a la basura.
Para apreciar completamente el descubrimiento del equipo de Kim, demos un paso atrás para preguntar:¿Qué sucede exactamente cuando un virus infecta nuestros cuerpos? ¿Y qué hace el sistema inmunitario al respecto?
Los fundamentos de la infección
Para causar una infección, un virus primero debe ingresar a una célula. Las membranas externas de las células normalmente son difíciles de penetrar sin un pase especial. Pero estos pequeños ladrones de cajas fuertes han descubierto cómo abrir un candado en la superficie de la celda, trepar, secuestrar la maquinaria de replicación de la celda, hacer millones de copias de sí mismos y salir para propagarse a otras celdas.
El candado que SARS-CoV-2 sabe abrir es ACE2, que aparece en la superficie de las células de la garganta, los pulmones, el corazón, los riñones, los intestinos y los revestimientos de los vasos sanguíneos. ACE2 es famoso, entre otras cosas, por ayudar a mantener baja la presión arterial. Pero al SARS-CoV-2 no le importa lo que hace ACE2 para ganarse la vida. Cualquier célula que tenga ACE2 es vulnerable a la infección por SARS-CoV-2.
Nuestro sistema inmunológico tiene formas de lidiar con tales intrusos. Al reconocer la presencia de un patógeno, las células B, que ayudan a formar nuestro sistema inmunológico, bombean una amplia variedad de anticuerpos dirigidos al invasor. Estas son moléculas especialmente adecuadas para adherirse a los patógenos como si fueran piezas de un rompecabezas y, cuando se unen en los lugares correctos y encajan bien, los dejan fuera de servicio.
Los anticuerpos que sobresalen en agarrarse a alguna característica crucial para el éxito de descifrado de cajas fuertes celulares del patógeno se declaran "neutralizantes":evitan que el patógeno infecte las células. Lo mejor de estos anticuerpos neutralizantes se puede convertir en medicamentos.
Por ejemplo, los pacientes hospitalizados con COVID-19 a menudo reciben una dosis de anticuerpos monoclonales:múltiples copias del mismo anticuerpo poderosamente neutralizante. El problema es que el SARS-CoV-2 es experto en modificar las formas de sus características vulnerables mediante la mutación, por lo que un anticuerpo monoclonal que alguna vez fue neutralizante pierde su control y ya no puede silenciar la nueva variante. La pandemia de COVID-19 ha sido un desfile de un artista del escape inmunológico tras otro.
Anticuerpo mejorado
"Es increíble", dijo Kim, quien pasó gran parte de su carrera trabajando en la industria farmacéutica. "Te tomas la molestia de desarrollar estos anticuerpos monoclonales, guiarlos a través de ensayos clínicos, establecer operaciones de fabricación y obtener una autorización de uso de emergencia de la FDA. Luego, meses después, el virus se transforma y el anticuerpo monoclonal ya no sirve".
De la más de media docena de anticuerpos monoclonales dirigidos contra el SARS-CoV-2 que han recibido una autorización de uso de emergencia, solo uno sigue en uso.
Pero el laboratorio de Kim tiene un anticuerpo mejorado que puede acabar con todos los interesados.
Todos los anticuerpos monoclonales que la FDA ha aprobado hasta ahora se adhieren al dominio de unión al receptor del SARS-CoV-2, o RBD. Ese es el "final comercial" de la infame proteína de pico del virus, la protuberancia viral que juega con ACE2 para lograr la admisión a las células. Al generar nuevas variantes con RBD mutados, el virus sigue sacudiéndose el control de los sucesivos anticuerpos monoclonales.
Pero la proteína espiga del SARS-CoV-2 contiene otras regiones que, a todos los efectos prácticos, no cambian. Se dice que estas regiones están altamente conservadas evolutivamente, lo que significa que no han cambiado con el tiempo, incluso entre cepas virales que difieren en otros lugares.
Entonces, ¿por qué no idear un anticuerpo monoclonal que persiga una de esas regiones conservadas? ¿Eso no resolvería el problema del escapista?
Sí, dijo Kim, quien es profesora de bioquímica en Virginia y D. K. Ludwig. "Pero hasta ahora, nadie ha encontrado un anticuerpo para una región conservada en el SARS-CoV-2 que no sea un cobarde". En otras palabras, parece que ninguno de estos anticuerpos son potentes anticuerpos neutralizantes:se quedan ahí sentados, cabalgando junto con el virus pero sin impedir que infecte las células.
Ya no es cobarde
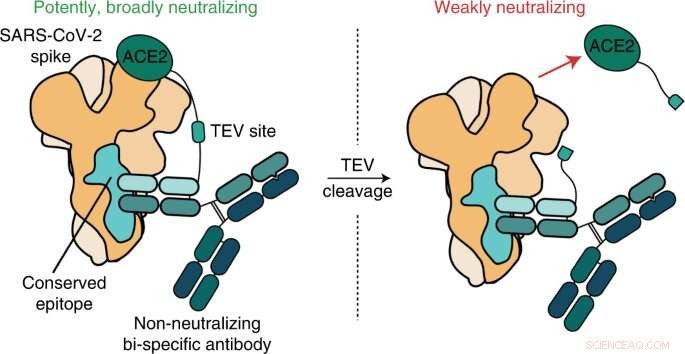
Kim le da crédito a Payton Weidenbacher, Ph.D., un ex estudiante graduado en su laboratorio, con un destello de ingenio que provocó el advenimiento de lo que llamaron "ReconnAbs" (abreviatura de "anticuerpos no neutralizantes conservados que bloquean los receptores"). .
La idea de Weidenbacher:tomar otra molécula que podría neutralizar el SARS-CoV-2 y vincularla a uno de estos anticuerpos débiles pero pegajosos que se unen a un sitio bien conservado en la proteína de pico viral.
"Muchos otros investigadores tiraban estos anticuerpos a la basura, y nosotros también", dijo Weidenbacher.
Encontraron un anticuerpo que se dirigía a una parte de la proteína espiga del SARS-CoV2 que nunca parece cambiar, sin importar qué nueva variante aparezca. Utilizando un fragmento de proteína flexible como correa, ataron este anticuerpo a la pieza de ACE2 que sobresale de la superficie celular, la parte a la que se adhiere el virus.
"No hay forma de que el SARS-CoV-2 pueda mutar para salir de su dependencia de ACE2", dijo Weidenbacher.
En una placa de laboratorio, la construcción atada demostró ser capaz de bloquear la infección por SARS-CoV-2 de células humanas normalmente susceptibles al virus. Ha funcionado en todas las cepas de SARS-CoV-2 probadas hasta BA.2.
El siguiente paso es probar ReconnAbs en animales.
Mirando más allá de la pandemia actual, Kim prevé que ReconnAbs sirva como un "kit de piezas" modular de mezcla y combinación que podría ponerse en acción rápidamente cuando llegue la próxima pandemia para detener el virus desde el principio mientras se espera lo esperado. desarrollo de medicamentos aún mejores.
Dicho kit contendría tres partes:anticuerpos que se sabe que se adhieren fuertemente a las regiones fuertemente conservadas de cualquier virus bien estudiado (por ejemplo, un coronavirus o un virus de la influenza); cualquier "bloqueo" de la superficie celular que el virus sepa cómo abrir para entrar en nuestras células; y pequeñas correas para engancharlos.
"Fue un golpe de creatividad", dijo Kim. "Payton en sentido figurado metió la mano en el cubo de la basura, sacó estos limones y los convirtió en limonada". Un nuevo y potente anticuerpo neutraliza todas las variantes conocidas del SARS-CoV-2