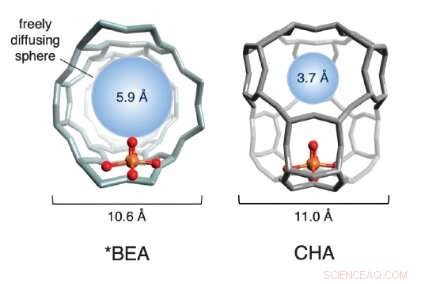
Una ilustración de las estructuras de la jaula de dos zeolitas a base de hierro utilizadas en el estudio. Las esferas rojas y doradas (que representan oxígeno y hierro, respectivamente) conforman el sitio activo. La estructura de la jaula, en gris, está formado de silicio, Aluminio y Oxigeno. La esfera azul cuantifica el tamaño de la molécula más grande que puede difundirse libremente dentro y fuera de la jaula del sitio activo (el diámetro del metano es ~ 4,2 Å). Crédito:Benjamin Snyder
Un equipo de investigadores de la Universidad de Stanford y la Universidad de Lovaina en Bélgica ha aclarado aún más un proceso intrigante que podría ser un paso importante hacia una economía de combustible de metanol con abundante metano como materia prima. un avance que podría cambiar fundamentalmente la forma en que el mundo usa el gas natural.
El metanol, el alcohol más simple, se usa para fabricar varios productos, como pinturas y plásticos, y como aditivo a la gasolina. Rico en hidrógeno, el metanol puede impulsar pilas de combustible de la nueva era que podrían producir importantes beneficios medioambientales.
Si es gas natural, del cual el metano es el componente principal, podría convertirse económicamente en metanol, el combustible líquido resultante se almacenaría y transportaría mucho más fácilmente que el gas natural y el hidrógeno puro. Eso también reduciría en gran medida las emisiones de metano de las plantas de procesamiento de gas natural y las tuberías. Hoy dia, metano escapado, un gas de efecto invernadero mucho más potente que el dióxido de carbono, casi niega las ventajas ambientales del gas natural sobre el petróleo y el carbón. El nuevo estudio del equipo en la edición actual de Ciencias es el último en avanzar en una forma de bajo consumo energético para producir metanol a partir de metano.
"Este proceso utiliza cristales comunes conocidos como zeolitas de hierro que se sabe que convierten el gas natural en metanol a temperatura ambiente, "explica Benjamin Snyder, quien obtuvo su doctorado en Stanford estudiando catalizadores para abordar facetas clave de este desafío. "Pero, Esta es una química extremadamente desafiante de lograr a nivel práctico, ya que el metano es obstinadamente químicamente inerte ".
Cuando se infunde metano en zeolitas de hierro porosas, el metanol se produce rápidamente a temperatura ambiente sin necesidad de calor o energía adicional. En comparación, el proceso industrial convencional para fabricar metanol a partir de metano requiere temperaturas de 1000 ° C (1832 ° F) y una presión extremadamente alta.
"Es un proceso económicamente tentador, pero no es tan fácil. Importantes barreras impiden la ampliación de este proceso a niveles industriales, "dijo Edward Solomon, Profesor de Stanford de química y ciencia de fotones en SLAC National Accelerator Laboratory. Solomon es el autor principal del nuevo estudio.
Manteniendo las zeolitas encendidas
Desafortunadamente, la mayoría de las zeolitas de hierro se desactivan rápidamente. Incapaz de procesar más metano, el proceso se agota. Los científicos han estado interesados en estudiar formas de mejorar el rendimiento de la zeolita de hierro. El nuevo estudio, coautor de Hannah Rhoda, un candidato a doctorado de Stanford en química inorgánica, utiliza espectroscopía avanzada para explorar la estructura física de las zeolitas más prometedoras para la producción de metano a metanol.

Hannah Rhoda con el equipo de espectroscopía de resonancia Raman, que dispara un láser en una muestra para obtener información vibratoria del sitio exacto que se está estudiando. Los investigadores del estudio actual utilizaron esta técnica para ayudar a asignar los sitios envenenados con Fe (III) -OH y Fe (III) OCH3, que iluminó el mecanismo. Crédito:Hannah Rhoda
"Una pregunta clave aquí es cómo sacar el metanol sin destruir el catalizador, "Dijo Rhoda.
Elegir dos atractivas zeolitas de hierro, el equipo estudió la estructura física de las celosías alrededor del hierro. Descubrieron que la reactividad varía drásticamente según el tamaño de los poros en la estructura cristalina circundante. El equipo se refiere a él como el "efecto jaula, "ya que la celosía encapsulante se asemeja a una jaula.
Si los poros de las jaulas son demasiado grandes, el sitio activo se desactiva después de un solo ciclo de reacción y nunca se vuelve a activar. Cuando las aberturas de los poros son más pequeñas, sin embargo, coordinan una danza molecular precisa entre los reactivos y los sitios activos de hierro, una que produce directamente metanol y regenera el sitio activo. Aprovechando este llamado 'efecto jaula, “El equipo pudo reactivar el 40 por ciento de los sitios desactivados repetidamente, un avance conceptual significativo hacia un proceso catalítico a escala industrial.
"El ciclo catalítico, la reactivación continua de los sitios regenerados, algún día podría conducir a producción económica de metanol a partir de gas natural, "dijo Snyder, ahora es un becario postdoctoral en UC-Berkeley en el Departamento de Química con Jeffrey R. Long.

Benjamin Snyder (derecha) y su ex asesor de doctorado, Edward Solomon, profesor de química en Stanford y de ciencia de fotones en SLAC. Crédito:Linda A. Cicero
Este avance fundamental en la ciencia básica ayudará a los químicos e ingenieros químicos a dilucidar el proceso que utilizan las zeolitas de hierro para producir metanol a temperatura ambiente. pero queda mucho por hacer antes de que tal proceso pueda industrializarse.
El siguiente en la lista de Snyder:abordar el logro del proceso no solo a temperatura ambiente sino utilizando aire ambiental en lugar de alguna otra fuente de oxígeno, como el óxido nitroso utilizado en estos experimentos. Tratar con un poderoso agente oxidante como el oxígeno, que es notoriamente difícil de controlar en reacciones químicas, será otro obstáculo considerable a lo largo del camino.
Por ahora, Snyder estaba complacido y asombrado por los poderes ilustrativos de la sofisticada instrumentación espectroscópica en los laboratorios de Solomon que se aprovecharon para este estudio. Estos fueron invaluables para su comprensión de la química y las estructuras químicas involucradas en el proceso de metano a metanol.
"Es genial cómo se puede obtener información muy poderosa a nivel atómico, como el efecto jaula, de estas herramientas que no estaban disponibles para generaciones anteriores de químicos, "Dijo Snyder.