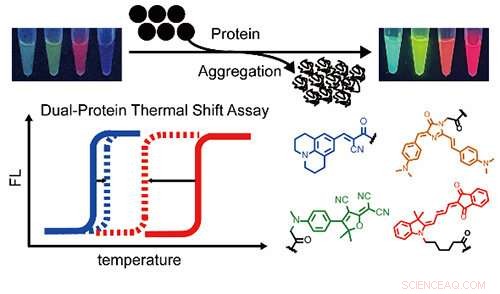
Una serie de sensores de agregación de proteínas de varios colores y un ensayo de cambio térmico de dos colores para informar sobre la coagregación de proteínas de dos proteínas diferentes de forma simultánea y cuantitativa. Crédito:BAI Yulong
La coagregación de múltiples proteínas patógenas es común en las enfermedades neurodegenerativas. Sin embargo, la deconvolución de dicho proceso bioquímico sigue siendo un desafío.
Recientemente, un grupo de investigación dirigido por el profesor Liu Yu del Instituto de Física Química de Dalian (DICP) de la Academia de Ciencias de China desarrolló un ensayo de cambio térmico fluorogénico de dos colores para demostrar simultáneamente la agregación de dos proteínas diferentes y estudiar cuantitativamente su estabilidad termodinámica durante coagregación.
Este estudio fue publicado en Ciencia química .
Los investigadores desarrollaron sensores de agregación de proteínas fluorogénicas multicolores para expandir la cobertura espectral. Luego cuantificaron los cambios en las temperaturas de fusión en un sistema de proteínas modelo heterocigoto, lo que reveló que la estabilidad termodinámica de las proteínas de tipo salvaje estaba significativamente comprometida por las mutantes, pero no al revés.
También examinaron cómo los ligandos de moléculas pequeñas interferían selectiva y diferencialmente con dicha interacción.
"Estos sensores son adecuados para visualizar cómo diferentes proteínas ejercen influencia entre sí sobre su coagregación en células vivas," "dijo el profesor Liu.
En particular, Investigaron cómo las proteínas amiloidogénicas de transtiretina interactuaban con las proteínas de la apolipoproteína IV durante su proceso de coagregación. lo que indicó que la apolipoproteína IV era un acompañante farmacológico.