Una ilustración que muestra el punto de acceso controlado por pinzas ópticas para la caracterización estructural de proteínas mediante espectroscopía Raman mejorada en la superficie. Crédito:Vince St. Dollente Mesias, Jinqing Huang / Universidad de Ciencia y Tecnología de Hong Kong
Es un desafío analizar proteínas a bajas concentraciones, especialmente para aquellos en una mezcla de varias conformaciones como proteínas intrínsecamente desordenadas (IDP). Un equipo de investigación dirigido por el profesor Huang Jinqing, Profesor adjunto del Departamento de Química de la Universidad de Ciencia y Tecnología de Hong Kong (HKUST), ha desarrollado espectroscopía Raman acoplada a pinzas ópticas que puede sondear directamente las características estructurales de la alfa-sinucleína, un desplazado interno estrechamente vinculado a la enfermedad de Parkinson, a la concentración fisiológica centrándose en moléculas de proteína individuales.
Los desplazados internos desempeñan un papel importante en los procesos biológicos y muchos de ellos están asociados con enfermedades neurodegenerativas incurables. Como un desplazado interno típico, La alfa-sinucleína carece de una arquitectura 3-D estable conocida como estructuras secundarias. Sufre espontáneamente conversiones de una estructura secundaria a otra, lo que eventualmente podría resultar en la acumulación de agregados de proteínas involucrados en la patología de la enfermedad de Parkinson. Sin embargo, las especies transitorias durante la conversión poseen varias estructuras y existen en una población baja entre una mezcla de equilibrio dinámico. Por lo tanto, sus características estructurales suelen estar ocultas bajo los resultados de detección de las técnicas de medición tradicionales, que promedian las señales detectadas a partir de grandes cantidades de muestras y un tiempo de detección prolongado.
En el estudio, La profesora Huang y sus colaboradores integran pinzas ópticas y espectroscopía Raman mejorada en superficie (SERS) en una plataforma novedosa para generar mejoras SERS sintonizables y reproducibles con sensibilidad de nivel de molécula única en entornos acuosos. con el fin de caracterizar a estos desplazados internos manteniendo su heterogeneidad intrínseca de gran trascendencia biológica. Específicamente, un punto de acceso se puede visualizar y controlar con pinzas ópticas para permitir que las proteínas pasen por una cámara de flujo de microfluidos, lo que hace conveniente ajustar los parámetros de medición en tiempo real para las caracterizaciones espectroscópicas in situ. Identifica directamente las características estructurales de las especies transitorias de alfa-sinucleína entre sus monómeros predominantes a una concentración fisiológica de 1 μM al reducir el promedio del conjunto en cantidad y tiempo, proporcionando una visión profunda para comprender el inicio de la agregación de proteínas amiloides. Por eso, esta plataforma SERS tiene un gran potencial para revelar la información estructural de los desplazados internos en la dinámica, heterogéneo, y sistemas biológicos complejos.
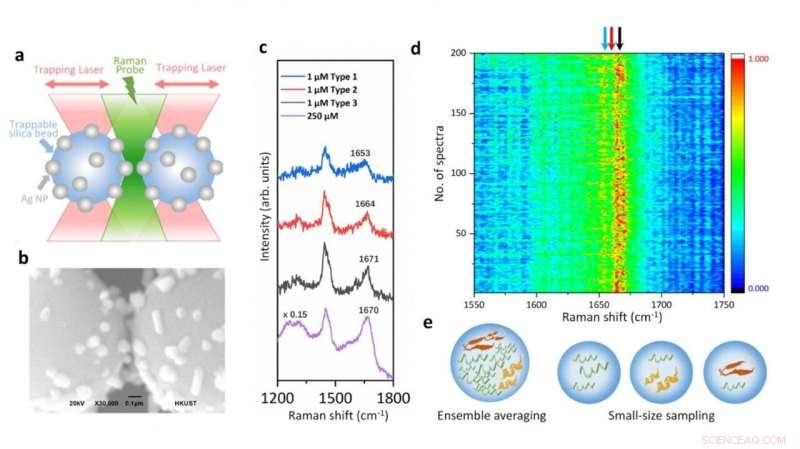
Ilustración de la plataforma de espectroscopía Raman acoplada a pinzas ópticas y espectros SERS de alfa-sinucleína a concentración fisiológica que muestra las variaciones estructurales surgidas de sus especies transitorias. Crédito:Vince St. Dollente Mesias, Jinqing Huang / Universidad de Ciencia y Tecnología de Hong Kong
"Nuestra estrategia permite el control preciso del punto de acceso entre dos perlas de sílice recubiertas con nanopartículas de plata del tamaño de un micrómetro atrapadas para mejorar la eficiencia y la reproducibilidad de SERS en detecciones acuosas. Excepto por la mejora sintonizable de SERS, las pinzas ópticas integradas también ofrecen una resolución espacial subnanométrica y una sensibilidad de fuerza sub-piconewton para monitorear las interacciones luz-materia en el punto de acceso plasmónico para una visión física adicional. Más importante, nuestro método abre una nueva puerta para caracterizar las especies transitorias de desplazados internos en soluciones diluidas, que sigue siendo un desafío importante en la comunidad biofísica. Por último, Será emocionante aprovechar al máximo la manipulación precisa de la fuerza de las pinzas ópticas integradas para desplegar una única proteína dentro del hotspot controlable y resolver su dinámica estructural a partir de las vibraciones moleculares endógenas mediante la espectroscopia Raman integrada. ", dijo el profesor Huang.
El estudio fue publicado recientemente en la revista científica Comunicaciones de la naturaleza .