Un interruptor dependiente del potencial ayuda a la división del agua utilizando catalizadores de óxido de cobalto, Investigadores de Boston College y Yale University informan en la revista Chem. Una pequeña carga eléctrica impulsa una reacción de desprendimiento de oxígeno que utiliza agua para producir gas hidrógeno. Crédito: Chem
Usando cobalto abundante y un enfoque experimental único para probar formas de acelerar una reacción catalítica lenta para recolectar hidrógeno del agua, Investigadores del Boston College y la Universidad de Yale descubrieron un interruptor mecanicista en la reacción de evolución del oxígeno, un paso significativo hacia la optimización de los electrocatalizadores para la división del agua para producir energía limpia.
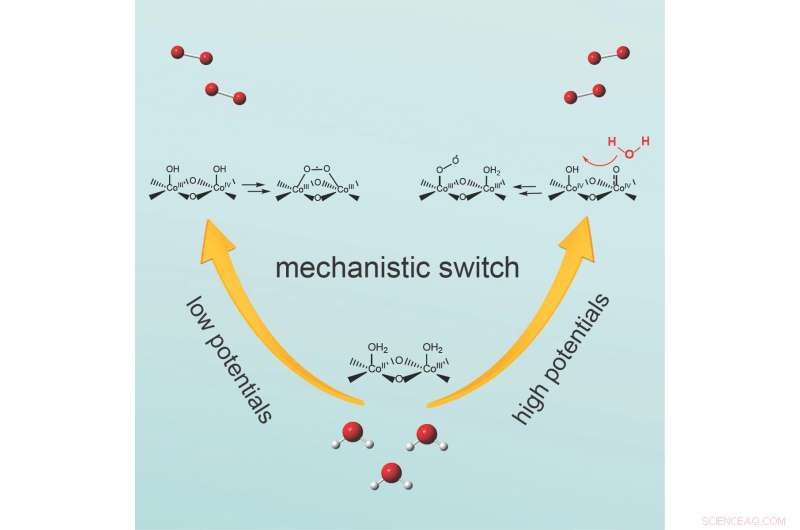
El mecanismo cambia variando la cantidad de voltaje, o potencial aplicado, el equipo informa en la revista Chem . A potencial moderado, dos átomos de oxígeno unidos a la superficie del catalizador reaccionan para formar el enlace oxígeno-oxígeno. Por el contrario, a potenciales más altos, el enlace oxígeno-oxígeno está formado por una molécula de agua que ataca una especie de oxígeno unida a la superficie.
Los hallazgos muestran que en esta clase de materiales, se debe elegir un electrocatalizador para esta reacción, u optimizado, dependiendo del régimen potencial en el que se espera que opere en un reactor. En otras palabras, un catalizador dado puede ser particularmente eficaz para promover un mecanismo, pero no el otro.
"Lo que nos sorprendió fue la brusquedad con la que se produce el cambio de un régimen mecanicista a otro con potencial aplicado, "dijo el profesor de química de Boston College Dunwei Wang, un autor principal del informe. "Solo se necesitan unos 100 mV para alternar entre los dos mecanismos. Es un recordatorio de lo sensibles que son los mecanismos de reacción. En términos más generales, el sencillo cambio puede ser otra indicación de cómo la fotosíntesis puede adaptarse a los cambios en el entorno de reacción para optimizar el rendimiento ".
Los investigadores han estado trabajando para dividir el agua en hidrógeno molecular y oxígeno en un esfuerzo por proporcionar abundante energía renovable en forma de gas hidrógeno transportable y almacenable. La división se puede lograr con electrocatálisis, un proceso en el cual las reacciones de desprendimiento de hidrógeno y oxígeno ocurren en compartimentos separados espacialmente en electrodos. Eso hace que la electrocatálisis sea un medio muy prometedor para producir gas hidrógeno limpio.
Sin embargo, la reacción de desprendimiento de oxígeno (REA) es lenta, dijo Wang. Como resultado, la velocidad de la reacción general de división del agua está limitada por la lenta REA. La reacción debe ser facilitada por catalizadores, es decir, materiales que promueven la reacción sin ser ellos mismos consumidos en el proceso. Hasta la fecha, Todavía no se han desarrollado electrocatalizadores económicamente viables para la promoción de la reacción de desprendimiento de oxígeno. Wang y sus colegas se centraron en los REA en electrocatalizadores prometedores en un esfuerzo por comprender mejor los procesos de reacción y utilizar esos conocimientos para diseñar electrocatalizadores más eficientes y estables para esta reacción.
Se centraron en la reacción en una clase de electrocatalizadores que se basan en óxidos de cobalto, un material barato y abundante en la tierra, atributos que se traducirían de manera eficiente para su uso a escala industrial, Dijo Wang.
En la ultima década, varios electrocatalizadores basados en óxido de cobalto han surgido como candidatos prometedores para promover los REA. En colaboración con colegas de la Universidad de Yale, Wang y su equipo estudiaron los REA en dos tipos de electrocatalizadores de óxido de cobalto con técnicas electroquímicas, espectroscopia infrarroja, y teoría funcional de la densidad.
Wang dijo que el equipo controló la concentración de agua mediante el uso de electrolitos de agua en sal. que presentan una concentración de sal que es aproximadamente diez veces mayor que la del agua de mar. Como resultado, los investigadores pudieron controlar la actividad del agua ajustando la cantidad de sal en el electrolito. Monitorearon cómo respondía la velocidad de la reacción a diferentes concentraciones de agua. Esto reveló el mecanismo de los REA en los electrocatalizadores a base de cobalto, Dijo Wang. El coautor y profesor asociado de química de BC Matthias Waegele y su equipo de investigación utilizaron espectroscopía infrarroja, que se basa en la interacción de la luz infrarroja con las moléculas, para detectar intermediarios de reacción de los REA en condiciones de funcionamiento.
Pudieron detectar un intermedio de reacción clave, lo que fue predicho por los cálculos del químico de Yale Víctor Batista y su grupo de investigación. Gary Brudvig, un químico inorgánico en Yale, también asesoró al equipo durante el proyecto.
Wang dijo que el equipo quería observar de cerca la reacción de evolución del oxígeno. particularmente la característica de que es un proceso paso a paso, ni un solo evento. El agua contiene solo un átomo de oxígeno. El producto de los REA es oxígeno molecular, que contiene dos átomos de oxígeno. Por lo tanto, durante los REA se forma un enlace oxígeno-oxígeno, El lo notó.
Wang dijo que los investigadores en este campo se han centrado en dos preguntas centrales:¿cómo se forma este enlace de oxígeno y en qué paso? Se han propuesto dos mecanismos principales en estudios previos, sin embargo, los investigadores aún tenían que resolver en qué condiciones experimentales:temperatura, o potencial de electrodo aplicado, por ejemplo, se forma el enlace oxígeno-oxígeno y cuál de los mecanismos es el dominante.
Wang y sus colegas decidieron observar de cerca cómo el potencial del electrodo aplicado dicta el mecanismo del paso de formación del enlace oxígeno-oxígeno, ya que las reacciones en la electrocatálisis son impulsadas por un potencial eléctrico que se aplica al catalizador.
Los hallazgos sugieren que el cambio mecanicista podría ser general para los electrocatalizadores a base de óxido, Dijo Wang.
"Estamos muy interesados en saber si esta observación también se aplica a otros electrocatalizadores prometedores, ", dijo." En particular, actualmente estamos trabajando en catalizadores con centros activos definidos atómicamente. A diferencia de los electrocatalizadores a base de cobalto, cuya estructura atómica en el centro activo permanece sin resolver, nuestra nueva plataforma de estudio contiene centros catalíticos que están bien definidos atómicamente. Será muy interesante ver si el cambio mecanicista inducido por el potencial también ocurre en esos catalizadores ".