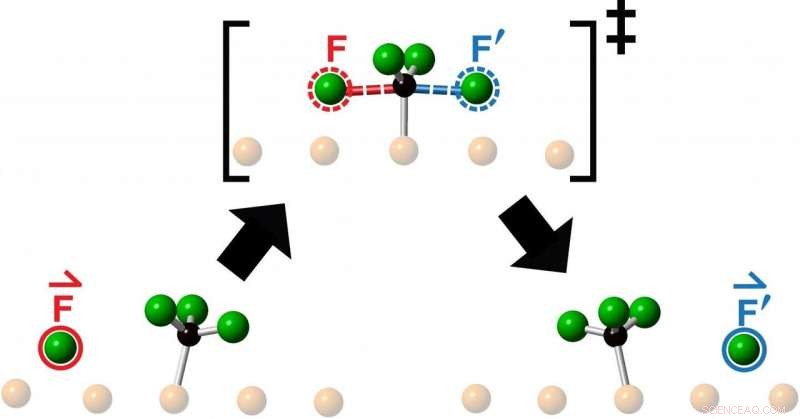
La interpretación de un artista de la barrera de energía que un átomo de flúor reactivo debe cruzar al chocar con una molécula de fluorometilo en su camino para formar un producto como resultado de una reacción química. Investigadores de la Universidad de Toronto observaron la eyección colineal 'en cadena' del producto de reacción (rodeado en azul) en la continuación de la dirección de la molécula de reactivo entrante (rodeada en rojo). Crédito:Lydie Leung
Investigación de un equipo de químicos de la Universidad de Toronto, dirigido por el investigador ganador del Premio Nobel John Polanyi, está arrojando nueva luz sobre el comportamiento de las moléculas cuando chocan e intercambian átomos durante la reacción química. El descubrimiento arroja dudas sobre un modelo teórico de 90 años del comportamiento del "estado de transición", intermedio entre reactivos y productos en reacciones químicas, abriendo una nueva área de investigación.
Los investigadores estudiaron las colisiones obtenidas mediante el lanzamiento de un átomo de flúor en el centro de una molécula de fluorometilo, formada por un átomo de carbono y tres átomos de flúor, y observaron la reacción resultante utilizando microscopía de túnel de barrido. Lo que vieron después de cada colisión fue la expulsión de un nuevo átomo de flúor moviéndose colinealmente a lo largo de la continuación de la dirección de aproximación del átomo de flúor entrante.
"Los químicos arrojan moléculas a otras moléculas todo el tiempo para ver qué sucede o con la esperanza de hacer algo nuevo, "dice Polanyi, Profesor universitario en el Departamento de Química de la Facultad de Artes y Ciencias de la U of T y autor principal de un estudio publicado este mes en Química de las comunicaciones . "Descubrimos que apuntar una molécula de reactivo al centro de una molécula objetivo, restringe el movimiento del producto emergente a una sola línea, como si el producto hubiera sido directamente "golpeado". La sorprendente observación de que el producto de reacción emerge en línea recta, moviéndose en la misma dirección que el átomo de reactivo entrante, sugiere que los movimientos que conducen a la reacción se asemejan a una simple transferencia de impulso hacia adelante.
"La conservación del momento lineal que observamos aquí sugiere un 'estado de transición' de corta duración, en lugar de la opinión anterior de que hay tiempo suficiente para la aleatorización del movimiento. Newton lo haría, Creo, Me ha complacido que la naturaleza permita un simple evento en cadena para describir algo tan complejo como una reacción química, "dice Polanyi.

El estudiante graduado de la Universidad de Toronto, Matthew Timm, prepara un microscopio de efecto túnel para un experimento que controla el resultado de una reacción química seleccionando el parámetro de impacto de las colisiones moleculares. Crédito:Diana Tyszko
El equipo, que incluía a la investigadora asociada senior Lydie Leung, el estudiante graduado Matthew Timm y Ph.D. graduado Kelvin Anggara, había establecido previamente los medios para controlar si una molécula lanzada hacia otra colisiona de frente con su objetivo o falla en una cantidad elegida, una cantidad conocida como parámetro de impacto. Cuanto mayor sea el parámetro de impacto, cuanto mayor sea la distancia por la cual la molécula entrante no alcanza a la molécula objetivo. Para el nuevo trabajo, los investigadores emplearon un parámetro de impacto de cero para dar una colisión frontal.
"Llamamos a este nuevo tipo de reacción química unidimensional 'imitación', dado que encontramos que el producto se golpea a lo largo de la continuación de la dirección del enfoque del reactivo, "dice Polanyi." Los movimientos se asemejan al golpe de las bolas de acero de la cuna de un Newton. Las bolas de acero de la cuna no se atraviesan, pero transfiere el impulso de manera eficiente a lo largo de una sola línea.
"Similar, Nuestras reacciones en cadena transfieren energía a lo largo de filas de moléculas, favoreciendo así una reacción en cadena. Esta conservación de la energía de reacción en la química de reacción podría ser útil a medida que el mundo avanza hacia la conservación de la energía. Por ahora, sirve como un ejemplo de reacción química en su forma más simple ".
Se sabe desde hace más de un siglo que existe una barrera energética que los reactivos químicos deben cruzar en su camino para formar productos de reacción. Un estado de transición energizado existe brevemente en la parte superior de la barrera en una configuración crítica, sin estado de transición, sin reacción.
Polanyi dice que la observación del 'knock-on' colineal proporciona información sobre el complejo de colisión reactivo, que dura aproximadamente una millonésima de segundo. "Nuestros resultados nos dicen claramente que el estado de transición en la parte superior de la barrera de energía dura tan poco tiempo que no puede alterar completamente sus momentos. En cambio, recuerda la dirección de donde vino el átomo de flúor atacante ".
En la década de 1930, Los químicos comenzaron a calcular la probabilidad de formar un estado de transición asumiendo que mezcla su energía, como una molécula caliente. Aunque era una suposición, parecía bien establecido y dio lugar a la "teoría del estado de transición" estadístico de las velocidades de reacción. Este sigue siendo el método preferido para calcular las velocidades de reacción.
"Ahora, con la capacidad de observar los reactivos y los productos a nivel molecular, se puede ver con precisión cómo se acercan los reactivos y, posteriormente, cómo se separan los productos, "Dice Polanyi." Pero esto va en contra del modelo estadístico clásico de 90 años. Si la energía y el impulso fueran aleatorios en el estado de transición caliente, los productos no mostrarían una memoria clara de la dirección de aproximación de los reactivos. La aleatorización de energía funcionaría para borrar esa memoria ".
Los investigadores dicen que el movimiento direccional observado de los productos de reacción favorece un modelo determinista del estado de transición para reemplazar el modelo estadístico de larga data. Adicionalmente, la dinámica de reacción observada permite que la energía del reactivo se transmita en sucesivas colisiones colineales.