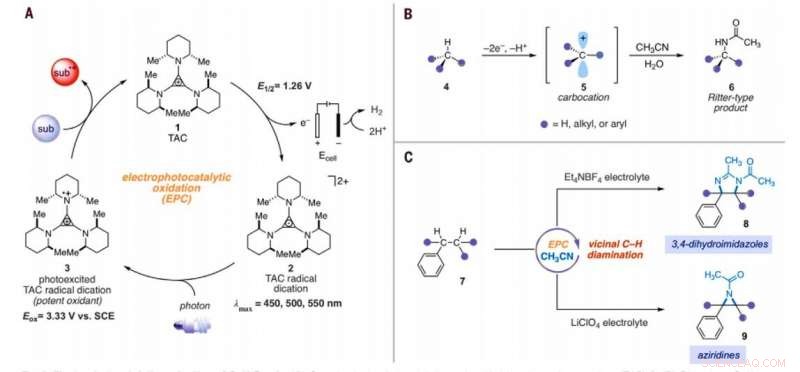
Aminación electrofotocatalítica de enlaces C – H. (A) Ciclo electrofotocatalítico genérico con trisaminociclopropenio (TAC) 1. (B) Reacción de aminación C – H tipo Ritter. (C) Reacciones electrofotocatalíticas de diaminación de C – H vecinal informadas en este trabajo. Sub, sustrato; subox, sustrato oxidado; Me, metilo; Et, etilo; C.A, acetilo; Eox, potencial de oxidación; lmax, longitud de onda de máxima absorción. Crédito:Ciencia, 10.1126 / science.abf2798
Química Inorgánica, la conversión de enlaces carbono-hidrógeno (C-H) inactivados en enlaces carbono-nitrógeno (C-N) es una transformación muy valorada. Los científicos pueden lograr tales reacciones en un solo sitio C-H ya que la primera derivatización puede disminuir la reactividad de los enlaces C-H circundantes. En un nuevo informe ahora publicado en Ciencias , Tao Shen y Tristan H. Lambert en el departamento de química y biología química, Universidad de Cornell, Nueva York, demostró que los arenos alquilados podrían sufrir reacciones de diaminación C-H vecinales para formar 1, Derivados de 2-diamina utilizando una estrategia electrofotocatalítica. Durante el proceso sintético, utilizaron acetonitrilo como disolvente y fuente de nitrógeno. Catalizaron la reacción usando un ion trisaminociclopropenio (TAC), que sufrió oxidación anódica para proporcionar una dicación radical estable (cualquier catión), mientras que la reacción catódica redujo los protones a hidrógeno molecular. Cuando irradiaron el radical TAC con una luz fluorescente compacta de luz blanca, generaron un intermedio fotoexcitado fuertemente oxidante. Según el electrolito utilizado, el equipo obtuvo 3, Productos con 4-dihidroimidazol o aziridina.
Un nuevo proceso sintético
Las reacciones químicas ubicuas que convierten enlaces inertes carbono-hidrógeno (C-H) en valiosos enlaces carbono-nitrógeno (C-N) pueden acelerar enormemente la construcción de moléculas complejas relevantes para la empresa biomédica. Por lo tanto, los investigadores han derivado una serie de reacciones de aminación de C-H, pero a pesar de su poder y alcance, muchas campañas sintéticas deben instalar numerosos vínculos C-N. Un desafío importante para el desarrollo de tales reacciones químicas es que la heterofuncionalidad tiende a desactivar los enlaces circundantes hacia los modos mecánicos típicos de activación de C – H. Por lo tanto, solo unas pocas tecnologías de reacción han logrado hasta ahora funciones multipotentes en enlaces C-H proximales. Shen y col. describió una estrategia para la química de oxidación potente mediante la combinación de la energía de la luz y la electricidad dentro de un solo catalizador en un proceso conocido como electrofotocatálisis (EPC). Durante esta estrategia, El equipo utilizó la oxidación electroquímica del ion trisaminociclopropenio (TAC) bajo un potencial electroquímico relativamente suave y la irradiación concomitante de luz visible para excitar el intermedio catiónico radical resultante. El radical fotoexcitado fue un oxidante extremadamente potente que demostró reacciones desafiantes que incluyen funciones oxidativas del benceno y otros arenos pobres en electrones o la funcionalización regioselectiva C-H de éteres.
Alcance del sustrato de diaminación C – H vecinal electrofotocatalítica. Todos los rendimientos son de productos aislados. Los productos se obtuvieron como mezclas racémicas; Las representaciones de cuñas y rayas indican relaciones estereoquímicas relativas. (A) Diaminación de alquilbencenos secundarios. (B) Diaminación de alquilbencenos primarios. Los detalles experimentales se proporcionan en los materiales complementarios. Un asterisco indica funcionamiento a 2,2 V; un símbolo de daga (†) indica tratamiento con NaHCO3 (aq) y CH3OH; y un símbolo de doble daga (‡) indica nBu4NPF6 en lugar de Et4NBF4. SM, materiales para empezar. El compuesto 36 se desaciló tras el tratamiento. Crédito:Ciencia, 10.1126 / science.abf2798 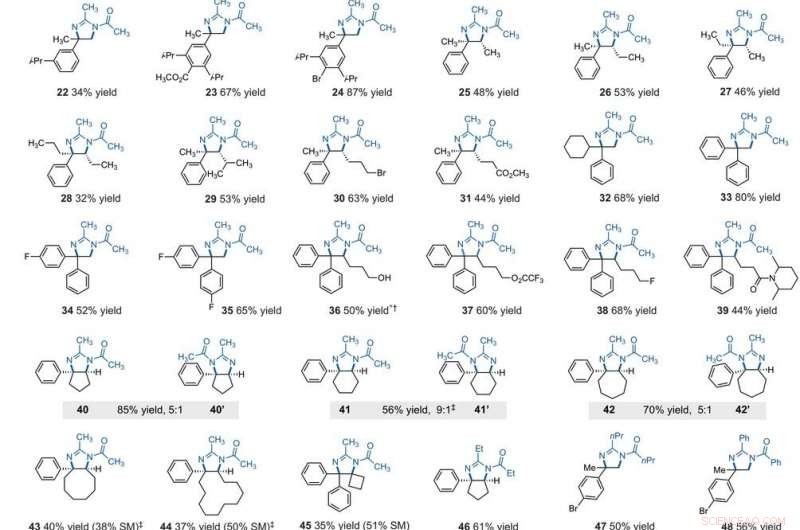
El equipo planteó la hipótesis del poder oxidante de TAC para permitir también otros múltiples de activación de enlaces C-H. En las condiciones adecuadas, el enfoque electrofotocatalítico podría generar carbo-catión intermedios para facilitar la funcionalización de tipo Ritter de enlaces C-H sin un oxidante químico externo. Típicamente, durante las reacciones de tipo Ritter se genera un carbocatión con el subsiguiente atrapamiento por un nitrilo para formar intermedios de iones de nitrilo seguidos de productos amida después de la hidrólisis. El equipo asumió que el fuertemente oxidante, sin embargo, las condiciones selectivas ofrecidas por TAC (trisaminociclopropenio) EPC (electrofotocatálisis) podrían permitir una secuencia de múltiples reacciones de funcionalización C-H de tipo Ritter, donde el grupo acetamida formado inicialmente facilitó una segunda reacción de aminación en una posición adyacente. Si es factible, el método podría facilitar la aminación regioselectiva de dos enlaces C-H simplemente usando luz visible, un potencial electroquímico suave y un solvente común como fuente de nitrógeno en lugar de precursores de nitreno. Shen y col. reported the realization of the electrophotocatalytic deamination of C-H bonds to furnish dihydroimidazoles or aziridines, depending on the type of electrolyte used during the experiments.
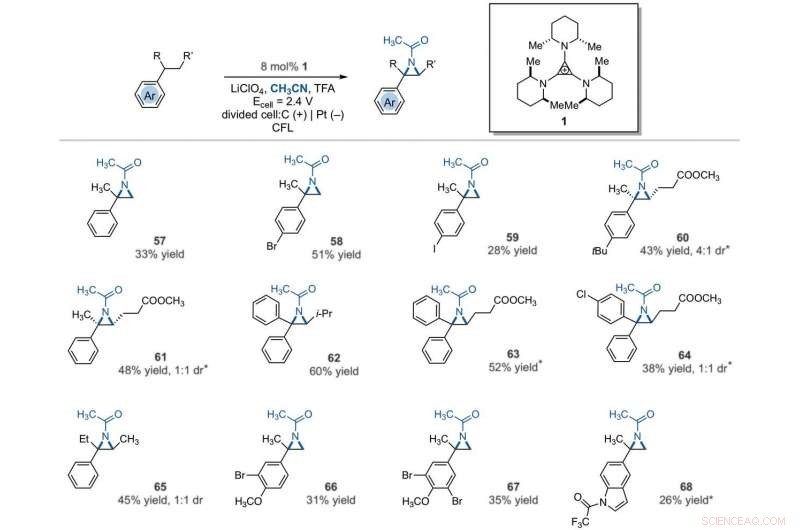
Electrophotocatalytic vicinal C–H aziridination. Detailed reaction conditions for each substrate are provided in the supplementary materials. Products were obtained as racemic mixtures; wedge and dash depictions indicate relative stereochemical relationships. An asterisk indicates run at 2.2 V. i-Pr, isopropyl. Credit:Science, 10.1126/science.abf2798
The synthetic products
After extensively screening, the reaction conditions including the cell potential, electrólito, acid additive and reaction time, Shen et al. identified conditions to assist the efficient conversion of a variety of benzylic hydrocarbons of the corresponding N-acyl-4, 5-dihydroimidazole adducts. In the reaction setup, the scientists used visible light irradiation with a white compact fluorescent light of a solution of the substrate containing TAC in a divided electrolytic cell under controlled potential. The team added the TAC catalyst and substrate within the anodic chamber where the C-H deamination chemistry occurred. The resulting redox by-product was effectively traceless. Based on similar conditions, a variety of benzylic hydrocarbons underwent vicinal C-H diamination to form diverse products. En todos los casos, the researchers noted how the function of methylene carbons occurred in preference to methyl carbons, even when in the presence of a sterically demanding group or electron-withdrawing group. Since the α-α-diaryl amines formed a valuable substructure in biomedically relevant compounds, the team also investigated the transformation on gem-diaryl substrates. They found that the 1, 1-diphenyl ethane reacted efficiently to furnish a secondary alkyl benzene compound with 80 percent yield. The compatibility of alcohol, ester, alkyl fluoride and amide substituents allowed the synthesis of more highly functionalized adducts.
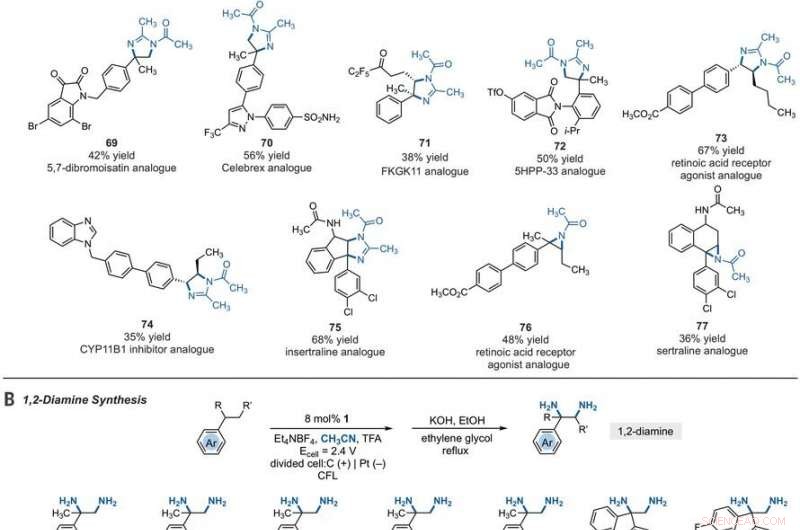
Synthetic applications of electrophotocatalytic vicinal C–H diamination. (A) Bioactive compound analogs prepared by means of electrophotocatalytic vicinal C–H diamination or aziridination. (B) 1, 2-Diamine synthesis. (C) Dihydroimidazole synthesis. (D) Bioactive compound synthesis. Detailed reaction conditions are provided in the supplementary materials. Products were obtained as racemic mixtures; wedge and dash depictions indicate relative stereochemical relationships. Products 80 and 81 were isolated as bis tosylate salts. Ph, fenilo; Tf, trifluoromethanesulfonate. Credit:Science, 10.1126/science.abf2798
Functionalizing ring systems
The team further studied the potential of this reaction to functionalize ring systems. The reaction of phenyl cyclopentane led to the bicyclic compound in 85 percent yield. The scientists produced six- and seven-membered ring products as regioisomeric mixtures, alongside eight- and 12-membered ring products as single isomers. They improved some of the yields for cyclic substrates by using tetrabutylammonium phosphate (TBAF 6 ) as the electrolyte. In addition to acetonitrile, the researchers used other nitriles to give rise to diaminated products derived from propionitrile, butyl nitrile or benzonitrile as the nitrogen source. The scientists also tested the diamination process using unbranched benzylic substrates. Como resultado, imine and halogenated derivatives gave rise to aziridines in low to modest yields with nearly equal yields of diaminated products.
Mechanistic rationale for electrophotocatalytic vicinal C–H diamination. Voltages were measured in a 5:1 mixture of CH3CN and TFA to mimic the reaction conditions and are relative to SCE. Credit:Science, 10.1126/science.abf2798 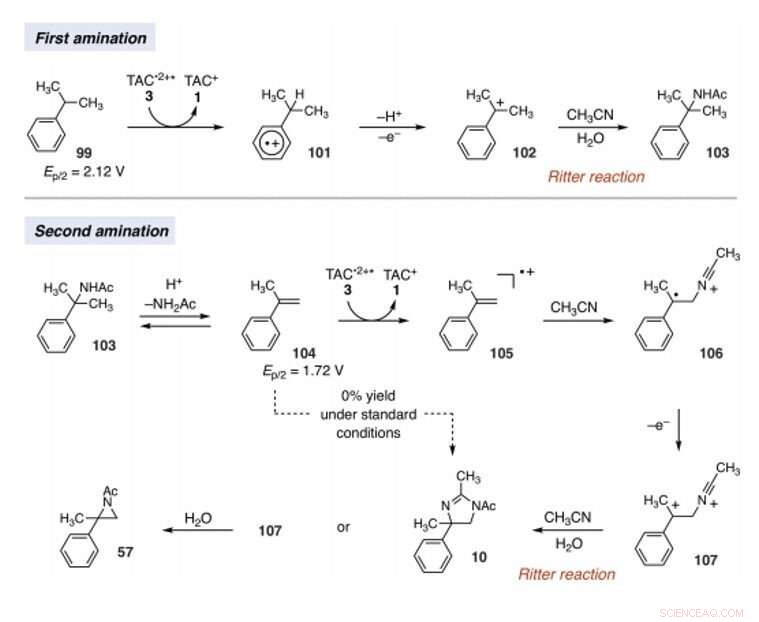
Since late-stage C-H functionalization processes offered powerful tools for the diversification of medicinal compound libraries, Shen et al. tested the difunctionalization chemistry on several molecules that are close analogs of known biologically active molecules. The team diaminated a dibromoisatin derivative to produce a bioactive molecule analogue in 42 percent yield. For example, Isatin derivatives have been investigated in the past due to their medicinal properties including antitumor and antiviral activities. The scientists also found that celecoxib analogs could produce 56 percent yield under standard conditions. They then converted an analog of thalidomide with antiproliferative activity into another bioactive analog with 50 percent yield. The team further found how a small modification to the electrophotocatalytic procedure could lead to the isolation of free 1, 2-diamines in good yields. Shen et al. believe the mechanisms to have originated with Ritter-type amination of the substrates benzylic C-H bond in a process that accords with known electrochemical Ritter-type reactions. De este modo, Tao Shen and Tristan H. Lambert noted the compatibility of deamination with a reasonable diversity of functionality for the practical applications of this reaction. The scientists used the power of combined light and electrical energy to conduct the reactions in the functionality of a single catalyst with advancing synthetic capabilities.
© 2021 Science X Network