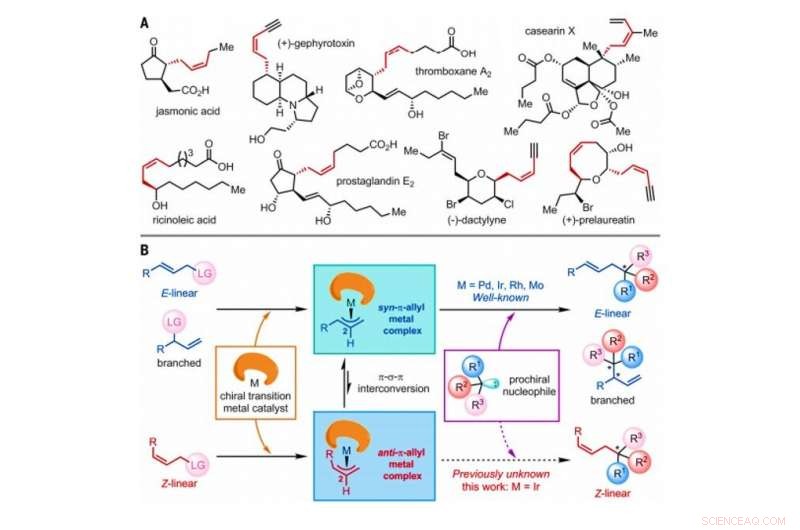
Estrategia para la construcción de Z-olefinas mediante reacciones asimétricas de sustitución alílica catalizadas por catalizadores de metales de transición. (A) Productos naturales seleccionados que contienen Z-olefinas con estereocentros homoalílicos. Me, metilo. (B) Mecanismo general propuesto de reacciones de sustitución alílica asimétrica catalizadas por metales de transición que involucran E-lineal, ramificado o sustratos de olefina lineal Z, todos los cuales incluyen un átomo o grupo de átomos denotado como grupo saliente (LG). Crédito:Ciencia, doi:10.1126 / science.abd6095
En química orgánica sintética, Las Z-olefinas son un objetivo sintético difícil de producir en el laboratorio debido a su relativa inestabilidad termodinámica. Las Z-olefinas forman un compuesto insaturado con una C norte H 2n fórmula que se puede isomerizar fácilmente. Las reacciones análogas que se utilizan para sintetizar productos de olefinas Z ópticamente activas son raras. En un nuevo informe ahora publicado en Ciencias , Ru Jiang y un equipo de investigación de la Academia de Ciencias de la Universidad de China en Shanghai, Porcelana, detalló una reacción de sustitución alílica asimétrica catalizada por iridio para retener las geometrías de las olefinas Z mientras se establece un estereocentro cuaternario adyacente. El equipo observó la formación de intermedios transitorios anti-π-alil-iridio y su captura por nucleófilos externos (donador de electrones) antes de la isomerización para formar homólogos de sin-π-alil-iridio termodinámicamente más estables. Los resultados proporcionan un método prometedor para preparar compuestos de olefina-Z quirales en el laboratorio.
Olefinas
El isómero geométrico de tipo Z de las olefinas se observa ampliamente como estructuras básicas en la naturaleza. Sin embargo, Las Z-olefinas son comparativamente menos estables en comparación con sus contrapartes de tipo E, y por lo tanto, es difícil sintetizarlos selectivamente en química orgánica. Los métodos comunes para acceder a las Z-olefinas incluyen la isomerización fotoinducida de las E-olefinas, Testigo de olefinación, Metátesis cruzada selectiva de Z, Acoplamiento cruzado con retención de Z y adición asimétrica de nucleófilos de Z-alilboro a cetonas e iminas. Las Z-olefinas con un estereocentro homoalílico suelen estar incrustadas en diversos productos naturales y moléculas bioactivas para generar un interés considerable en la química orgánica sintética. Los investigadores han demostrado la capacidad de realizar reacciones de sustitución alílica asimétricas catalizadas por metales de transición, incluido el molibdeno (Mo), paladio (Pd), iridio (Ir) y rodio (Rh). Desde su primer informe en 1997, Las reacciones de sustitución alílica asimétrica catalizadas por Ir han atraído una atención intensa debido a su naturaleza regio y enantioselectiva excepcionalmente alta. En este trabajo, Jiang y col. informaron reacciones de sustratos alílicos Z-lineales con triptaminas y triptofol. Durante el análisis exhaustivo de los mecanismos de reacción, notaron la formación de complejos clave anti-π-alil-iridio, antes de la isomerización para formar las contrapartes sin-π-alil-iridio termodinámicamente estables.
Alcance del sustrato de reacciones de sustitución alílica asimétrica retentiva de Z catalizadas por Ir de derivados de indol. Todas las reacciones se llevaron a cabo de acuerdo con las condiciones dadas aquí, a menos que se indique lo contrario. La relación geométrica de tipo Z a tipo E (Z / E) y la relación diastereomérica (dr) se determinaron mediante análisis de RMN 1H de las mezclas brutas. Se informan los rendimientos aislados de Z-3. Los valores de ee se determinaron mediante análisis de cromatografía líquida de alta resolución (HPLC) con una fase estacionaria quiral. El asterisco indica una relación Z / E de 7:1. El símbolo de una sola daga indica una relación Z / E de 8:1. El símbolo de doble daga indica que las reacciones se llevaron a cabo durante 1 día. El símbolo de sección indica una relación Z / E de 11:1. El símbolo de párrafo indica que las reacciones se llevaron a cabo utilizando acetato de (Z) -non-2-en-1-ilo, [Ir (DQO) Cl] 2 (3% en moles), (S) -L1 (6% en moles), InBr3 (1,0 equiv.), y bromuro de tetrabutilamonio (0,5 equiv.) en CHCl3 a 0ºC. El símbolo de libra indica que las reacciones se llevaron a cabo utilizando los acetatos alílicos Z correspondientes, [Ir (DQO) Cl] 2 (4,5% en moles), (S) -L2 (9% en moles), En (OTf) 3 (0,5 equiv. Para Z-3aS y Z-3aT; 1 equiv. Para Z-3aU) en CHCl3 a -10 ° C durante 2 días. Bn, bencilo; Bu, butilo; Et, etilo; Milisegundo, mesilo; Ph, fenilo; PMB, para-metoxibencilo; p-Tol, para-tolilo; Ts, tosyl. Crédito:Ciencia, doi:10.1126 / science.abd6095 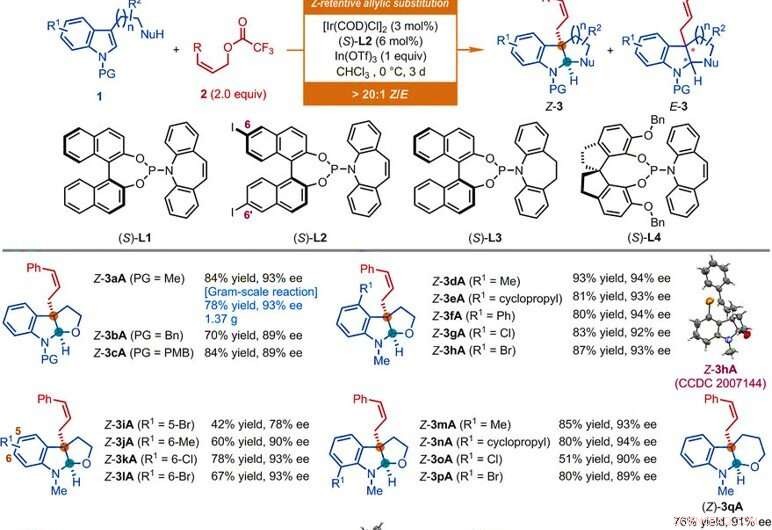
Los investigadores primero investigaron la reacción de desaromatización alílica asimétrica que involucra a nucleófilos como el N-metiltriptofol con derivados de Z-cinamilo. Al usar acetato de Z-cinnamilo, lograron la reacción deseada con un catalizador derivado del dímero de cloro ciclooctadieno de iridio (COD) en presencia de otros compuestos sintéticos. Los científicos obtuvieron el producto objetivo con rendimiento moderado y enantioselectividad con una relación geométrica de tipo Z a tipo E de 2:1. Luego optimizaron los componentes para mejorar la calidad y el rendimiento de los productos sintéticos. Basado en la reacción de sustitución alílica asimétrica Z-retentiva propuesta, Jiang y col. obtuvo diversa compatibilidad de grupos funcionales que toleraba un amplio alcance de sustrato. El equipo sintetizó con éxito más de 50 ejemplos de (homo) triptofol, triptaminas e indol sustratos que llevan un nucleófilo colgante basado en carbono utilizando derivados de Z-cinamilo. Casi todas las reacciones proporcionaron un rendimiento de relaciones de tipo Z a tipo E superiores a 20:1. Los ejemplos incluyen las correspondientes furoindolinas Z-cinnamiladas (abreviadas Z-3aA a Z-3pA), tetrahidropiranindolina (abreviado Z-3qA), pirroloindolinas (abreviado Z-3a'A a Z-3o'A) y hexahidrociclopentaindoles (abreviado Z-3a′′A a Z-3c′′A) con buenos rendimientos de hasta 94 por ciento. Generalmente, la sustitución de diversas propiedades electrónicas y estéricas en las posiciones disponibles del anillo de indol no tuvo ningún impacto perjudicial sobre la eficacia o enantioselectividad de la reacción. Los investigadores establecieron las estructuras y la configuración absoluta de los productos mediante análisis cristalográfico de rayos X. Luego también examinaron el desempeño de los derivados de D- y L-triptófano.
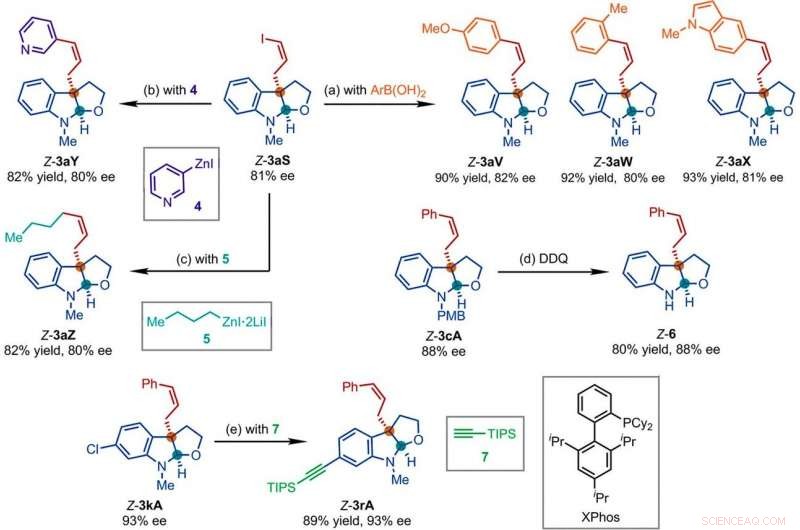
Productos representativos obtenidos en reacciones posteriores con los productos de la reacción de sustitución alílica asimétrica retentiva de Z catalizada por Ir. Condiciones de reacción:(a) Pd (PPh3) 4 (0,5% en moles), Cs2CO3 (2 equiv.), ArB (OH) 2 (1,5 equiv.), acetonitrilo, 50 ° C; (b) 4 (2 equiv.), THF / diglyme (1:1), 110 ° C, 24 horas; (c) 5 (2 equiv.), LiCl (4 equiv.), tolueno / THF / TMU, 110 ° C, 24 horas; (d) DDQ (1,5 equiv.), CH2Cl2, NaH2PO4 (acuoso 1 M); (e) 7 (2 equiv.), PdCl2 (CH3CN) 2 (5% en moles), XPhos (15% en moles), Cs2CO3 (2,5 equiv.), acetonitrilo, 80 ° C. Arkansas, arilo; THF, tetrahidrofurano; CONSEJOS, triisopropilsililo; TMU, 1, 1, 3, 3-tetrametilurea. Crédito:Ciencia, doi:10.1126 / science.abd6095
Transformaciones aguas abajo
A continuación, los investigadores estudiaron cómo varios productos de la reacción de sustitución alílica asimétrica retentiva en Z podrían investigarse fácilmente en diversas transformaciones posteriores. Por ejemplo, el yoduro de Z-vinilo de las furoindolinas quirales (abreviado Z-3aS) era reactivo frente a los ácidos arilborónicos y los reactivos de organocinc. Esto proporcionó una ruta alternativa para producir productos representativos con catalizadores de Ir, Reacciones de sustitución alílica asimétrica con retención de Z con altos rendimientos de hasta 82 a 93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Collectively, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
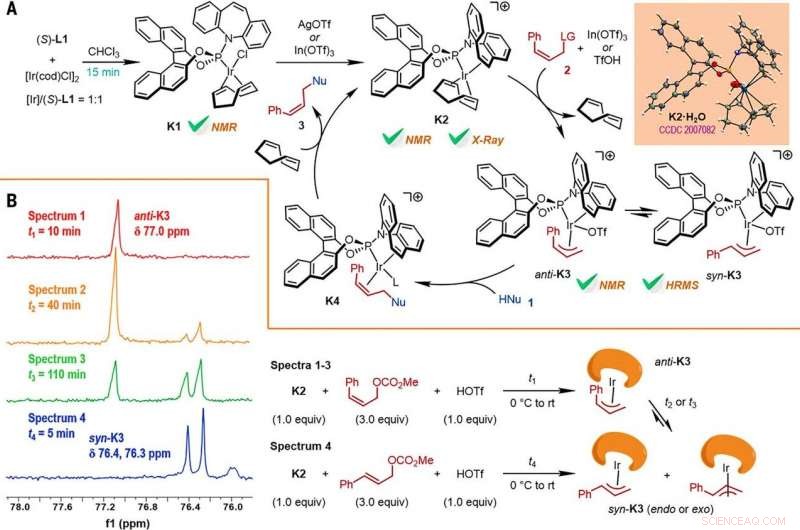
Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Crédito:Ciencia, doi:10.1126/science.abd6095
Exploring the synthetic spectrum
The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Como resultado, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. En este caso, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
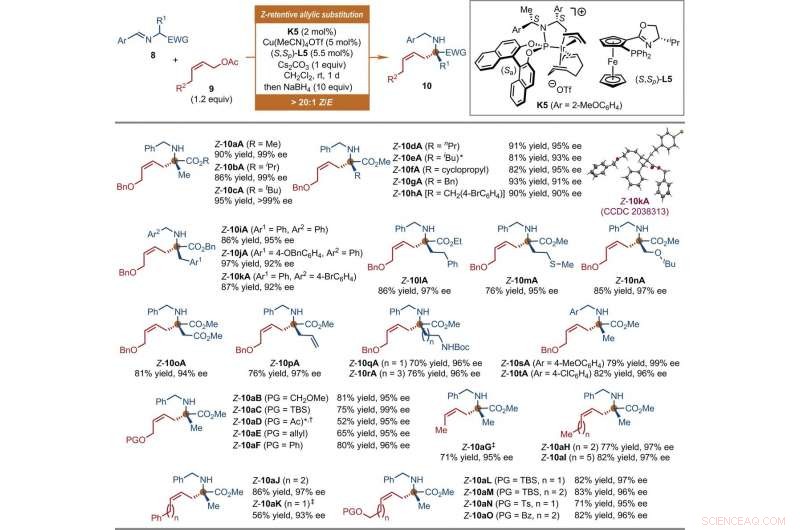
Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Crédito:Ciencia, doi:10.1126/science.abd6095
© 2021 Science X Network