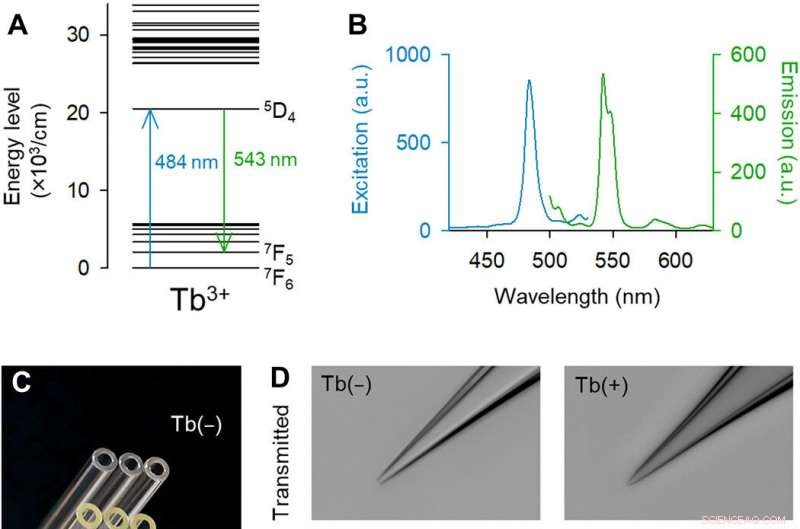
Las pipetas dopadas con Tb3 + emiten fluorescencia verde. (A) Diagrama de nivel de energía parcial de Tb3 + [extraído parcialmente de (14)]. (B) Espectros de excitación (azul) y emisión (verde) de vidrio dopado con Tb3 + al 3,1% en moles. (C) Fotografía en color macroscópica de los capilares de vidrio de control (superior) y de los capilares de vidrio dopados con Tb3 + (inferior). Crédito de la foto:Yuji Ikegaya, La Universidad de Tokio. (D) Imágenes monocromáticas de campo brillante (arriba) y de fluorescencia (abajo) de las puntas de las pipetas de vidrio de control (izquierda) y de vidrio dopado con Tb3 + (derecha) (excitación láser de 488 nm a 25 mW). Las pipetas hechas de vidrio dopado con Tb3 + emitieron fluorescencia verde. Crédito de la foto:Kazuki Okamoto, La Universidad de Tokio y la Universidad Juntendo. (E) Imagen de microscopía electrónica de barrido de la punta de una pipeta dopada con Tb3 +. Crédito de la foto:Hiroyuki Hioki, Universidad Juntendo. (F) Resistencias de pipeta de control (negro) y pipetas dopadas con Tb3 + (verde). Los rectángulos muestran las medianas y los percentiles 25 y 75, y los bigotes muestran los percentiles 10 y 90. n =48 pipetas, Prueba t de Student. (G) Lo mismo que (F) pero para capacitancias de pipeta. n =7 a 8 pipetas, Prueba t de Student. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529
Las investigaciones y manipulaciones ópticas a menudo forman el núcleo de los experimentos biológicos. En un nuevo informe ahora publicado en Avances de la ciencia , Kazuki Okamato y un equipo de científicos en ciencias farmacéuticas, neurociencia, medicamento, física e inteligencia artificial en la Universidad de Tokio, Japón, introdujo un nuevo material de vidrio de borosilicato que contiene un ion terbio de tierras raras (III) (Tb 3+ ). El material emitió fluorescencia verde tras la excitación de la luz azul, al igual que la proteína verde fluorescente (GFP) con una amplia compatibilidad en todos los entornos de investigación biológica. Utilizando micropipetas de vidrio dopado con terbio, Okamato y col. células marcadas con GFP dirigidas para electroporación de una sola célula, análisis de transcriptoma de una sola célula y experimentos de grabación de pinza de parche bajo control microscópico de fluorescencia en tiempo real. El vidrio también mostró una posible tercera generación de armónicos tras la excitación del láser infrarrojo, útil para el direccionamiento óptico en línea de neuronas marcadas con fluorescencia en el neocórtex in vivo. De este modo, el vidrio dopado con terbio simplificó múltiples procedimientos en experimentos biológicos con aplicaciones más amplias en la investigación biomédica.
Realización de investigaciones ópticas in vivo
Las investigaciones ópticas y las manipulaciones celulares dentro de los tejidos vivos están muy extendidas en la investigación biológica con capacidad para revelar diversas propiedades en las células y durante la comunicación intracelular. Si bien el etiquetado genético ha permitido la identificación de células que expresan proteínas fluorescentes, sigue siendo difícil acceder a las células marcadas con fluorescencia utilizando pipetas de vidrio, ya que el vidrio no es fluorescente en el rango visible. Para resolver estos problemas técnicos, Okamato y col. introdujo una nueva composición de vidrio de borosilicato. Los iones de tierras raras mostraron una emisión de fluorescencia única con picos agudos en el espectro de luz visible. El equipo se centró en el terbio (III) (Tb 3+ ), que tienen estructuras complejas de niveles de energía y teóricamente se espera que emitan fluorescencia verde. La longitud de onda de excitación estuvo cerca de la visibilidad más alta para los ojos humanos y cercana a la de la proteína verde fluorescente. Como resultado, pipetas hechas de vidrios dopados con terbio fueron útiles para fluorescencia, manipulación unicelular en ciencias de la vida.
Electroporación unicelular y análisis de transcriptomas dirigidos con fluorescencia utilizando pipetas dopadas con Tb3 +. (A) Electroporación de genes de celda única utilizando pipetas dopadas con Tb3 +. Se unió una pipeta dopada con Tb3 + que contenía un vector pCMV-tdTomato a una célula piramidal hipocampal positiva para EGFP en un cultivo organotípico (arriba; DiV 16), y se aplicaron pulsos eléctricos. Después de 48 horas, la neurona diana expresó tdTomato (abajo). Barra de escala, 20 μm. (B) Patch-seq usando pipetas dopadas con Tb3 +. Se unió una pipeta dopada con Tb3 + a una interneurona GABAérgica positiva para GFP en un corte agudo cortical de un ratón transgénico PV-GFP, y el ARN se extrajo aplicando succión (arriba). Barra de escala, 50 micras. Transcripciones por millón (TPM) de células GFP positivas y GFP negativas (abajo). Los puntos grises indican todas las transcripciones de genes detectadas. Los puntos rojos son transcripciones genéticas únicas representativas, Pvalb y Gad2 (GAD65) para células positivas para GFP versus Mef2c y Slc17a7 (VGLUT1) para células no positivas para GFP. Crédito de la foto:Kazuki Okamoto, La Universidad de Tokio y la Universidad Juntendo. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529 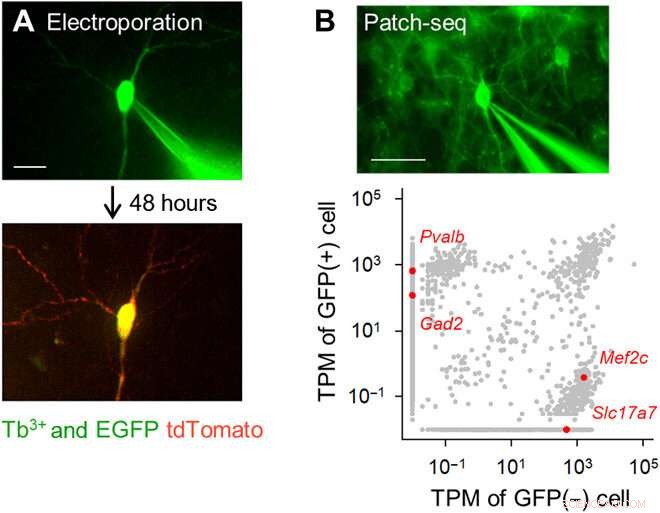
El equipo desarrolló el vidrio de borosilicato utilizando 3,1 por ciento en moles (% en moles) de óxido de terbio (Tb 2 O 3 ). El terbio (Tb 3+ ) -el vidrio dopado emitió una fluorescencia verde visible a simple vista, incluso bajo la luz de la habitación. La Tb 3+ -el vidrio dopado tenía un pico de absorción a una longitud de onda de 484 nm, que no se observó en vidrio de borosilicato normal sin terbio. Los científicos produjeron pipetas y capilares de vidrio donde el vidrio moldeado seguía emitiendo fluorescencia verde. Usando microscopía electrónica de barrido, el equipo revisó las puntas de las pipetas en busca de aberraciones que pudieran afectar la calidad de los registros electrofisiológicos. Okamato y col. Luego usó las nuevas micropipetas para llevar a cabo la electroporación unicelular de una proteína roja fluorescente (tdTomato) en neuronas en estructuras de corte organotípicas de hipocampo de rata. Observaron las pipetas que contenían el vector de tinte rojo y las células piramidales que estaban mínimamente etiquetadas con GFP mejorada. utilizando el mismo aparato óptico. Los científicos colocaron las puntas de las pipetas en las células y aplicaron pulsos eléctricos de electroporación para facilitar la expresión del tinte rojo después de 48 horas. Después de eso, El equipo realizó la secuenciación de ARN de una sola célula con las pipetas en cortes agudos de la corteza motora primaria de ratones transgénicos.
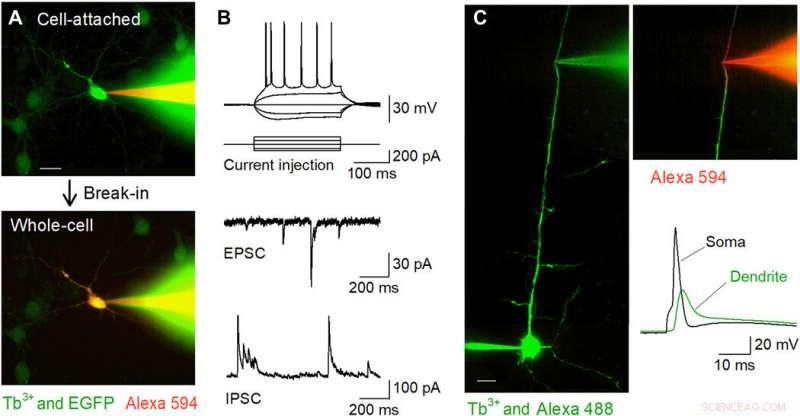
Grabaciones de pinza de parche dirigidas con fluorescencia in vitro utilizando pipetas dopadas con Tb3 +. (A) Imágenes confocales de disco de Nipkow durante la grabación de pinza de parche de una neurona hipocampal cultivada positiva para EGFP (verde) utilizando una pipeta dopada con Tb3 + (verde) llena de Alexa Fluor 594 (rojo). La celda se atrapó en el modo de celda adjunta (arriba) y luego se mantuvo en el modo de celda completa (abajo). Barra de escala, 20 μm. (B) Formas de onda representativas de potenciales de acción inducidos por inyección de corriente (arriba), EPSC espontáneos (centro), e IPSC espontáneas (abajo) registradas a partir de células piramidales CA1 en cortes de hipocampo agudo usando pipetas dopadas con Tb3 +. (C) Grabaciones de pinza de parche dendríticas dirigidas utilizando pipetas dopadas con Tb3 +. Una célula piramidal de capa 5 se cargó intracelularmente con Alexa Fluor 488 mediante registro de células completas somáticas, y su dendrita apical se apuntó para un mayor registro de células completas utilizando una pipeta dopada con Tb3 + bajo visualización confocal de disco de Nipkow. Barra de escala, 20 μm. Después del robo la dendrita se visualizó mediante Alexa Fluor 594 cargado intracelularmente a través de la pipeta dopada con Tb3 + (arriba a la derecha). La pipeta dopada con Tb3 + registró un potencial de acción de retropropagación después de un potencial de acción evocado en el soma (parte inferior derecha). Crédito de la foto:Kazuki Okamoto, La Universidad de Tokio y la Universidad Juntendo. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529
Uso de las nuevas micropipetas para grabaciones de pinza de parche in vitro
A continuación, los investigadores realizaron grabaciones de pinza de parche de cultivos primarios de neuronas del hipocampo que estaban escasamente etiquetadas con GFP utilizando una pipeta dopada con terbio cargada con un tinte fluorescente rojo (Alexa Fluor 594). Las pipetas llenaron con éxito las células objetivo con el tinte y las mantuvieron en la configuración de célula completa. El equipo aplicó el mismo método a las preparaciones de cortes cerebrales agudos donde las neuronas estaban ubicadas más profundamente en tejidos menos transparentes que las neuronas cultivadas. Cuando Okamato et al. células piramidales parcheadas en los cortes agudos del hipocampo usando pipetas dopadas con terbio, las neuronas mostraron potenciales de acción normales en respuesta a breves inyecciones de corriente. Las células exhibían corrientes postsinápticas excitadoras e inhibidoras espontáneas normales bajo la configuración de pinza de voltaje. Las micropipetas podrían usarse para grabaciones estables a largo plazo y también fueron útiles para grabaciones de neuritas. El equipo registró potenciales de acción que se propagaban hacia atrás utilizando la configuración de dendritas específicas.
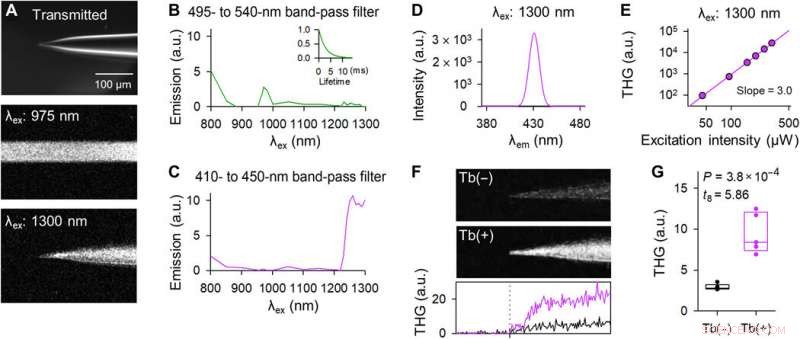
Las pipetas dopadas con Tb3 + emiten THG tras la excitación láser de 1300 nm. (A) Imágenes representativas de la punta de una pipeta dopada con Tb3 + en el campo brillante (arriba), Fluorescencia de dos fotones tras excitación láser de 975 nm (centro), y emisión armónica de tres fotones tras la excitación láser de 1300 nm (abajo). Las imágenes central e inferior se adquirieron con un escaneo horizontal de 2 μs por píxel y apiladas en z. (B) El espectro de excitación a través de un filtro de paso de banda de 495 a 540 nm. El gráfico de inserción indica la curva de disminución de la fluorescencia tras la excitación de 975 nm. (C) Lo mismo que (B) pero a través de un filtro de paso de banda de 410 a 450 nm. (D) El espectro de emisión tras la excitación de 1300 nm se midió usando un monocromador. (E) Gráfico logarítmico doble de la intensidad de THG en función de la potencia del láser de 1300 nm. La recta de regresión tenía una pendiente de 3,0. (F) Imágenes THG de las puntas de las pipetas de control (arriba) y pipetas dopadas con Tb3 + (centro). Las imágenes estaban apiladas en Z. El gráfico inferior muestra la intensidad de THG del control (negro) y las pipetas dopadas con Tb3 + (violeta). La línea de puntos vertical indica la ubicación de la punta. (G) Las intensidades de THG de las pipetas dopadas con Tb3 + (púrpura) fueron más fuertes que las de las pipetas de control (negras). Los rectángulos muestran las medianas y los percentiles 25 y 75. n =5 pipetas, Prueba t de Student. Crédito de la foto:Teppei Ebina, La Universidad de Tokio. Crédito:Science Advances, doi:10.1126 / sciadv.abd2529
Grabaciones de pinza de parche in vivo utilizando pipetas dopadas con terbio
Okamato y col. next characterized the nonlinear multiphoton excitation of terbium-doped glass using infrared light at wavelengths that were approximately double the single-photon excitation peak (484 nm) of terbium. Using a photomultiplier tube through a 495-to-540 nm band-pass filter, the team captured the green fluorescence emitted by terbium-doped pipettes. The emissions peaked at an excitation wavelength of 975 nm, suggesting that a laser wavelength corresponding to the value excited the glass through a two-photon absorption process. The scientists also noted another bright signal at 1300 nm excitation through a 410-to-450 band pass filter and suggested the signal to have likely arisen from third harmonic generation (THG). Based on the strong THG signal of the micropipettes, Okamato et al. conducted in vivo whole cell patch-clamp recordings with a multiphoton laser microscope. They simultaneously used the cells and terbium-doped pipette using dual-laser irradiation at 1, 040 nm and 1, 300 nm, respectivamente, and recorded the injection-induced action potentials and spontaneous membrane fluctuations under the current-clamp configuration.
THG-based in vivo patch-clamp recordings using Tb3+-doped pipettes. (A) Multiphoton image of an in vivo patch-clamp recording guided by THG of Tb3+-doped pipettes, targeting a cell labeled with tdTomato, which underwent two-photon excitation by a 1040-nm laser (red). The THG of the Tb3+-doped pipette was obtained using a 1300-nm laser (green). (B) Action potentials evoked by a step current injection (bottom) into a layer 2/3 pyramidal cell in the primary motor cortex (top) of an anesthetized mouse were recorded using a Tb3+-doped pipette. (C) Spontaneous membrane potentials were recorded using a Tb3+-doped pipette. Photo credit:Teppei Ebina, The University of Tokyo. Crédito:Science Advances, doi:10.1126/sciadv.abd2529 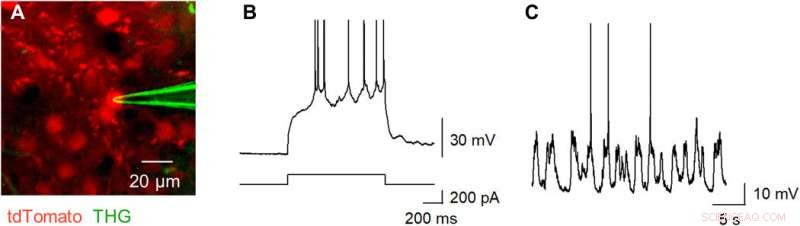
De este modo, Kazuki Okamato and colleagues invented a terbium-doped glass emitting green fluorescence signal strong enough to be visible to the naked eye. The material had similar characteristics to conventional borosilicate glass and did not display photobleaching or cytotoxicity. The new micropipettes allowed fluorescence manipulations such as optical targeting of single-cell electroporation, single-cell RNA sequencing and electrophysiological recordings. The glass also emitted third harmonic generation upon three-photon excitation, applicable for in vivo manipulation. The terbium-doped glass therefore provided a platform for multiple purposes in biomedical research including hitherto conventional patch-clamp recordings to open new frontiers in life sciences.
© 2021 Science X Network