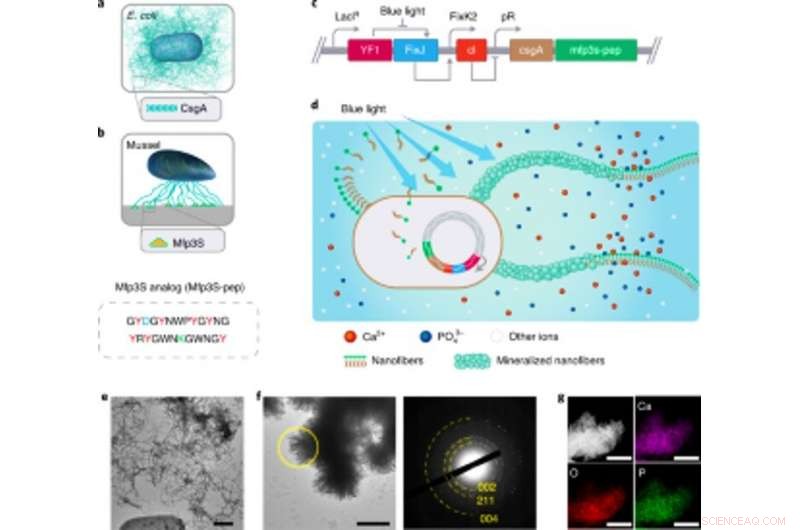
Ingeniería de biopelículas funcionales de E. coli sensibles a la luz como andamios para la mineralización de HA. Ingeniería de biopelículas funcionales de E. coli sensibles a la luz como andamios para la mineralización de HA. (a) Ilustración esquemática de biopelículas de E. coli de tipo salvaje que comprenden nanofibras de amiloide CsgA extracelulares, que son los principales componentes proteicos de las biopelículas que contribuyen a la adherencia robusta de las biopelículas a las superficies sólidas. (b) Ilustración esquemática de Mfps de las placas adhesivas del mejillón de California M. californianus. Mfp3S-pep (abajo) es un péptido adhesivo bioinspirado que imita la proteína Mfp3S original que se encuentra en las placas adhesivas de M. californianus. Mfp3S-pep está enriquecido con ácido aspártico (azul), residuos de lisina (verde) y tirosina (rojo), conocidos por sus roles funcionales en la promoción de la nucleación, crecimiento y adhesión de HA. (c) Esquema que muestra los componentes genéticos de la biopelícula de E. coli sensible a la luz. El diseño de biopelículas funcionales fue posible fusionando secuencias que codifican la proteína CsgA y Mfp3S-pep, ambos colocados corriente abajo del elemento de control transcripcional pDawn sensible a la luz. En el circuito pDawn, la expresión constitutiva de la histidina quinasa YF1 y su regulador de respuesta afín FixJ está estrechamente regulado por el promotor LacIq, mientras que la expresión del represor del fago λ cI está controlada por el promotor FixK2. Sobre la iluminación de luz azul, la actividad quinasa de YF1 y la consiguiente expresión de cI están inhibidas, que a su vez activa el promotor λ pR para promover la expresión de CsgA-Mfp3S-pep. (d) Esquema que muestra la deposición local de minerales HA en las nanofibras extracelulares funcionales compuestas de proteínas de fusión CsgA-Mfp3S-pep, secretada por E. coli sensible a la luz diseñada, la cepa lightreceiver-CsgA– Mfp3S-pep. (e) Imagen TEM que muestra células y matriz extracelular con abundantes fibras amiloides en las biopelículas. Barra de escala, 500 nm. F, Imagen TEM que muestra el compuesto formado y los cristales en forma de listón precipitados en las superficies de las nanofibras extracelulares después de 7 d de mineralización en 1,5 × SBF. El patrón SAED correspondiente presenta arcos de difracción asignados al (002), Aviones (211) y (004). Barra de escala, 500 nm. gramo, Mapeo EDS que ilustra el Ca, Elementos O y P intrínsecamente asignados a la fase HA. Barras de escala, 500 nm. Crédito: Biología química de la naturaleza , doi:https://doi.org/10.1038/s41589-020-00697-z
Los organismos vivos han desarrollado mecanismos de biomineralización para construir materiales compuestos estructuralmente ordenados y ambientalmente adaptables. Si bien los equipos de investigación han mejorado significativamente la investigación de mineralización biomimética en el laboratorio, Todavía es difícil diseñar compuestos mineralizados con características estructurales y componentes vivos como sus contrapartes nativas. En un nuevo informe ahora publicado en Biología química de la naturaleza , Yanyi Wang y un equipo de investigación en física, materiales avanzados, Biología sintética, e ingeniería en China, desarrolló compuestos vivos estampados y degradados inspirados en materiales graduados naturales. En este trabajo, combinaron la formación de biopelículas bacterianas inducibles por luz con la mineralización de hidroxiapatita (HA) biomimética, para mostrar cómo se podría controlar la ubicación y el grado de mineralización. Las células de los compuestos permanecieron viables mientras detectaban y respondían a las señales ambientales. Los compuestos mostraron un aumento de 15 veces en el módulo de Young (es decir, rigidez, la relación entre tensión y deformación) después de la mineralización. El trabajo arroja luz para desarrollar compuestos vivos con capacidad de respuesta dinámica y adaptabilidad ambiental.
Biomineralización en el laboratorio
El organismo vivo puede producir una variedad de estructuras compuestas orgánico-inorgánico jerárquicas basadas en la biomineralización, donde ejemplos notables incluyen los dientes radulares de quitones, escamas de pescado y mandíbulas de cangrejo de río que cumplen diversas funciones biológicas. El momento y el grado de biomineralización deben ser controlados con precisión por las células para formar estructuras y funciones precisas en los organismos vivos. Investigaciones recientes en mineralización biomimética habían resaltado la importancia de explorar enfoques controlados por células para producir patrones de vida y compuestos graduados como un área prometedora pero en gran parte inexplorada. Las disciplinas de la biología sintética y la ciencia de los materiales han desatado una gama de circuitos genéticos sofisticados y respetuosos con el medio ambiente para bioingeniería de una gama de nuevas funciones celulares. En este trabajo, Wang y col. desarrollado bioinspirado, materiales compuestos vivos aprovechando las biopelículas de Escherichia coli inducibles por la luz junto con la mineralización biomimética. El trabajo abrirá puertas para integrar células diseñadas para producir materiales mineralizados con características estructurales y vivas.
Mineralización espacialmente controlable de biopelículas inducibles por luz para composites estampados vivos. (a) Esquema de la configuración experimental y pasos secuenciales para producir composites estampados vivos. El patrón de hoja azul representado en la ilustración se proyectó en una placa de Petri que contenía la cepa lightreceiver-CsgA-Mfp3S-pep suspendida en medio. La luz azul desencadena la formación de biopelículas funcionales a través de la expresión regulada por la luz de las proteínas CsgA-Mfp3S-pep de la cepa lightreceiver-CsgA-Mfp3S-pep. El medio de cultivo en la placa de Petri se reemplazó luego con 1,5 × SBF, seguido de incubación a 37 ° C para formar compuestos. Después del proceso de mineralización, Se añadió aTc para inducir la expresión de una proteína roja fluorescente (mCherry). (b) Imagen de la cámara digital de las biopelículas estampadas teñidas con CV. Barra de escala, 1 cm. (c) Imágenes SEM que muestran la morfología de la superficie de las biopelículas modeladas. Barras de escala:2 µm (izquierda), 1 µm (derecha). (d) Imagen de una cámara digital del subsiguiente compuesto mineralizado que retuvo el patrón original. Barra de escala, 1 cm. (e) Imágenes SEM que muestran las microestructuras superficiales del compuesto mineralizado. Barras de escala:2 µm (izquierda), 1 µm (derecha). (F, g) Análisis microscópico de barrido láser confocal de la viabilidad bacteriana en biopelículas (f) y compuestos (g). Barras de escala, 5 µm. Tenga en cuenta que el colorante SYTO 9 y el PI se aplicaron como agentes de etiquetado para teñir células vivas (verde) y muertas (rojas). respectivamente. (h) Fluorescencia inducida del compuesto vivo registrada con un sistema ChemiDoc XRS. Barra de escala, 1 cm. I, La microscopía confocal demostró la expresión de mCherry de las bacterias en el compuesto. Barra de escala, 20 µm. j, Imágenes confocales de un compuesto vivo después de inducir la expresión de mCherry y etiquetar con calceína, lo que indicó una distribución homogénea de componentes orgánicos y minerales inorgánicos dentro de los compuestos vivos modelados. Barras de escala, 20 µm. Crédito: Biología química de la naturaleza , doi:https://doi.org/10.1038/s41589-020-00697-z 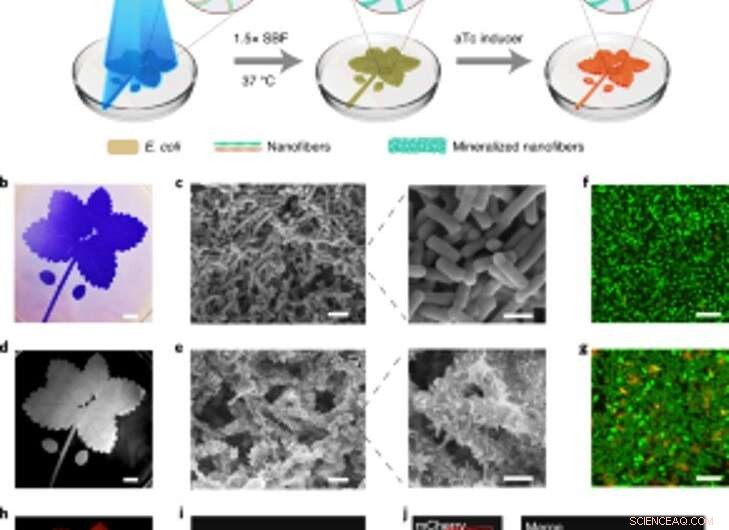
El equipo seleccionó proteínas de fusión para diseñar la mineralización que promueve las biopelículas de E. coli. Basado en experimentos previos, seleccionaron la proteína Mefp5, originaria de Mytilus edulis, seguido de Mfp3S, que se origina en Mytilus californianus y otra variante del péptido Mfp3S (Mfsp3S-pep) para iniciar la mineralización y promover la adhesión. El equipo construyó proteínas de fusión que contienen un dominio proteico principal de la biopelícula de E. coli para formar proteínas de fusión CsgA-Mfp y confirmó su secreción potencial a partir de células manipuladas. Luego seleccionaron la proteína de fusión CsgA-Mfp3S-pep como representante de la mineralización de hidroxiapatita y realizaron experimentos para verificar la función de la proteína para resaltar su papel durante la mineralización y la formación de cristales. Después de eso, Wang y col. construyó una cepa formadora de biopelícula inducible por luz llamada luz receptor -CsgA-Mfp3S-pep que se puede regular estrictamente mediante iluminación de luz azul.
La cepa sensible a la luz podría generar materiales de biopelícula funcional después de la iluminación con luz para promover la mineralización de hidroxiapatita (HA). Para validar esto, los científicos expusieron la cepa sensible a la luz a la luz azul en una placa de Petri y utilizaron tinción histológica y microscopía electrónica de transmisión (TEM) para mostrar la producción de fibras amiloides en las biopelículas. Relativamente, no observaron fibras amiloides en muestras cultivadas en la oscuridad. La matriz extracelular diseñada también actuó como plantilla para la mineralización de HA a tiempo, que confirmaron después de 7 días de incubación basados en técnicas de difracción de rayos X (XRD) y espectroscopía de rayos X de dispersión de energía (EDS).
Mineralización de densidad controlable en biopelículas de gradiente reguladas por intensidad de luz utilizadas para fabricar compuestos graduados vivos. (a) Ilustración esquemática que muestra la generación de compuestos de gradiente vivo a través de la mineralización in situ de biopelículas con densidades de biomasa en gradiente. Las biopelículas de gradiente se formaron proyectando luz con diferentes intensidades y un control espacial preciso en la placa de Petri que contiene la cepa lightreceiver-CsgA-Mfp3S-pep suspendida en el medio. (b) Imagen de una cámara digital que muestra biopelículas teñidas con CV con densidades de biomasa en gradiente. Barra de escala, 1 cm. (c) Imagen de cámara digital de compuestos vivos en gradiente formados posteriormente después de la mineralización de HA. Barra de escala, 1 cm. (d) El espesor de las biopelículas y los compuestos mineralizados posteriormente formados bajo diferentes intensidades de luz. Los resultados se presentan como media ± desviación estándar. Los datos son representativos de n =5 experimentos independientes. (e) Micrografías seccionales SEM que muestran las morfologías de diferentes regiones (A1-A4) en las biopelículas graduadas por intensidad de luz. Barras de escala, 10 µm. La imagen insertada (tomada de la región A4) representa la morfología superficial típica de las biopelículas. Barra de escala, 1 µm. (f) Micrografías seccionales SEM que muestran las morfologías de diferentes regiones (B1-B4) en los compuestos de gradiente vivo como plantilla por andamios de biopelícula graduada por intensidad de luz. Barras de escala, 10 µm. La imagen insertada (tomada de la región B4) representa la morfología superficial típica de los compuestos de gradiente mineralizado. Barra de escala, 1 µm. Tenga en cuenta que los porcentajes de opacidad del 100%, 50%, 25% y 12,5% corresponden a intensidades de luz reales de 0,0306 W cm − 2, 0,0268 W cm − 2, 0,0178 W cm − 2 y 0,0140 W cm − 2, respectivamente. Crédito: Biología química de la naturaleza , doi:10.1038 / s41589-020-00697-z 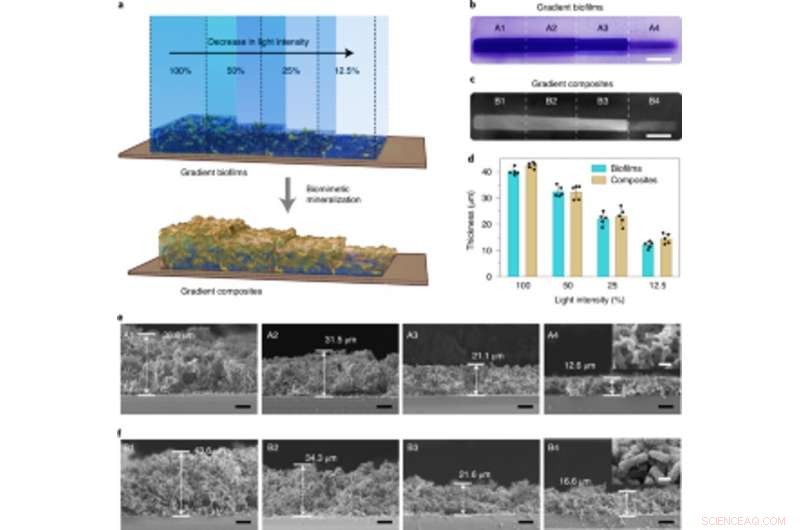
Basado en la naturaleza sensible a la luz de las biopelículas diseñadas, Wang y col. manipulación de la formación de biopelículas en el espacio-tiempo para controlar la formación de compuestos. Lo lograron iluminando un patrón de hojas en cultivos bacterianos líquidos en placas de poliestireno Petri que recapitulaban fielmente el patrón de luz proyectada sobre las biopelículas bacterianas. Después de 7 días de mineralización, el material compuesto generado en las placas de Petri retuvo el patrón original como se observó mediante microscopía electrónica de barrido. El enfoque de luz regulada controlaba la forma del compuesto basándose en proyecciones de patrones de cuadrícula y resolución espacial de la luz en la microescala, comparable al tamaño de las bacterias vivas. Luego, el equipo verificó la viabilidad de live, células intactas mediante la ingeniería de los compuestos vivos para expresar proteínas fluorescentes, como se confirmó usando imágenes de microscopía confocal. Después de eso, utilizaron análisis termogravimétrico para cuantificar los componentes inorgánicos de compuestos mineralizados, donde el material inorgánico aumentó proporcionalmente con el tiempo de inmersión en fluido corporal simulado (SBF). Wang y col. también comparó el módulo de Young de la biopelícula utilizando una técnica de micro-indentación para mostrar cómo la mineralización fortaleció las biopelículas de E. coli para proteger las células.
Compuestos de gradiente de densidad controlada
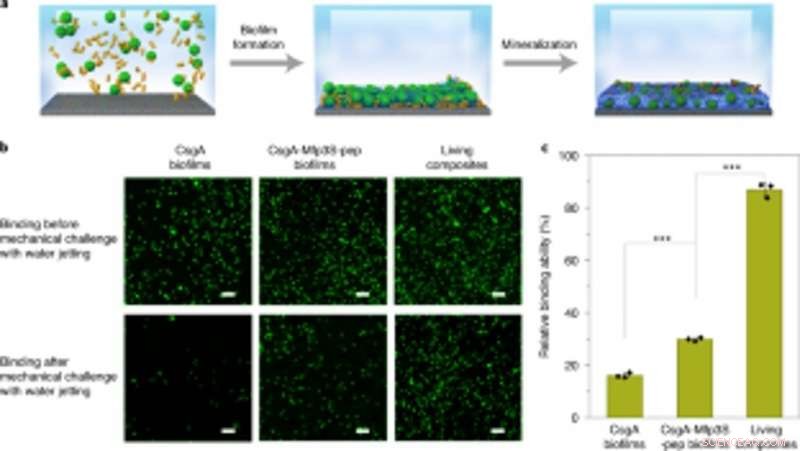
Acoplamiento de biopelículas diseñadas con mineralización para una captura e inmovilización robustas de microesferas en sustratos. (a) Esquema que muestra la captura e inmovilización de microesferas en un portaobjetos de vidrio en solución. Las microesferas de PS suspendidas en medio de cultivo se capturaron e inmovilizaron sobre un sustrato mediante la formación de biopelículas seguido de mineralización en 1,5 x fluido corporal simulado (SBF). (b) Imágenes fluorescentes que muestran los dos tipos de biopelículas (columnas izquierda y central) y microesferas vivas inmovilizadas con compuesto (columna derecha) en los sustratos antes (arriba) y después (abajo) del desafío con chorro de agua a una presión de descarga constante de 8 psi. Barras de escala, 100 µm. (c) Cuantificación de las capacidades relativas de diferentes biopelículas y compuestos vivos para pegar e inmovilizar microesferas de PS en el sustrato. Los resultados se presentan como media ± desviación estándar. De izquierda a derecha:P =0,00003, P =0,000004. *PAG <0,05, **PAG <0.01, ***PAG <0,001. Las estadísticas se derivan mediante una prueba t de dos caras. Los datos son representativos de n =3 experimentos independientes. Crédito: Biología química de la naturaleza , doi:https://doi.org/10.1038/s41589-020-00697-z
Los enfoques de ingeniería de tejidos han enfatizado la necesidad de identificar con precisión entre los tejidos duros y blandos para un desempeño fisiológico exitoso. por lo tanto, la intensidad de la luz podría ajustarse para controlar la densidad y las propiedades mecánicas de los materiales vivos diseñados. Zhang y col. logró esto al exponer cultivos de E. coli a diferentes intensidades de iluminación para revelar cómo el espesor de la biopelícula disminuyó con la intensidad decreciente de la luz azul. Además, mostraron cómo la mineralización estaba dirigida de manera estrecha y local por las proteínas de fusión Mfsp3S-pep modificadas genéticamente. Luego estudiaron las propiedades mecánicas locales de las regiones iluminadas con microdentadura para observar un aumento de cuatro veces en el módulo de Young para resaltar los compuestos vivos diseñados con gradientes minerales sintonizables y propiedades mecánicas para interfaces regenerativas tejido-hueso en aplicaciones de ingeniería de tejido óseo.
Implementación de compuestos vivos para la reparación de daños específicos del sitio
Los científicos también estudiaron la capacidad de las biopelículas diseñadas para agregarse para reparar daños al pegar microesferas de poliestireno. junto con la mineralización de HA. Como prueba de concepto, aplicaron compuestos mineralizados vivos para rellenar y reparar grietas diseñadas en la superficie de una placa de Petri de poliestireno. Durante los experimentos, las biopelículas adhesivas inducidas por la luz capturaron microesferas en solución para rellenar el surco dañado creado a propósito, mientras que las nanofibras en las biopelículas actuaron como una plantilla para la mineralización de hidroxiapatita para consolidar la cementación inducida por la luz bajo iluminación de luz azul. Usando microscopía electrónica de barrido, Wang y col. mostró cómo las bacterias y la matriz extracelular circundante se adhieren con microesferas para ilustrar la función adhesiva de las biopelículas vivas. Los compuestos mineralizados con HA formaron densos, Capas similares al concreto que limaron el surco dañado para resaltar la funcionalidad de mineralización de los compuestos vivos para una mayor durabilidad y aplicaciones de reparación.
Aplicación de mineralización viva controlable para reparaciones de daños específicos del sitio. (a) Esquema que muestra la aplicación de compuestos mineralizados vivos para rellenar y reparar grietas en la superficie de una placa de PS Petri. De izquierda a derecha:surco dañado en el sustrato de la placa de Petri, Las biopelículas adhesivas inducidas por la luz capturan microesferas en solución para rellenar el surco dañado. y las nanofibras en las biopelículas actúan como plantilla para la mineralización de HA para consolidar el cemento. (b) Imagen SEM que muestra el surco dañado. Debajo, un diagrama esquemático que ilustra las dimensiones del surco dañado. Barra de escala, 50 µm. C, Imágenes SEM que muestran la morfología del surco dañado lleno de biofilm y microesferas. Barras de escala:50 µm (superior), 5 µm (parte inferior). (d) Imágenes SEM que muestran la morfología del surco dañado después de la mineralización; HA llena los espacios entre esferas. Barras de escala:50 µm (arriba), 5 µm (parte inferior). Tenga en cuenta que los experimentos de reparación de daños específicos del sitio se repitieron al menos tres veces con resultados idénticos. Crédito: Biología química de la naturaleza , doi:10.1038 / s41589-020-00697-z 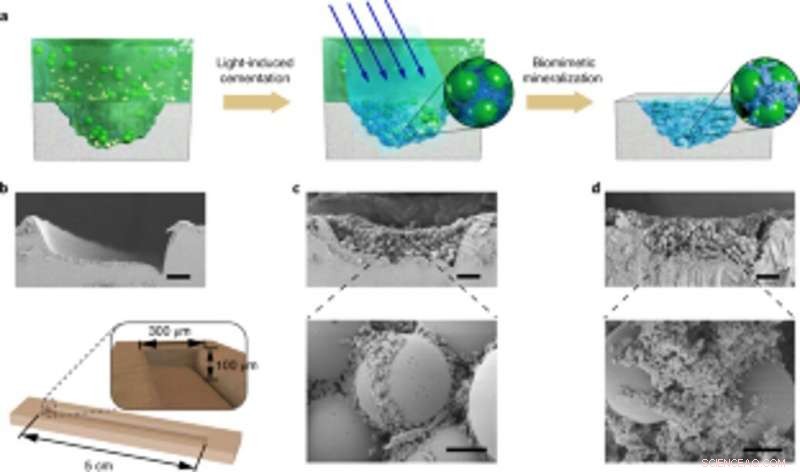
De este modo, Yanyi Wang y sus colegas produjeron compuestos con patrones vivos bioinspirados y compuestos graduados vivos con una plataforma de biopelícula regulada por luz. Los compuestos resultantes mostraron una respuesta ambiental similar a sus contrapartes nativas. Las células dentro de los compuestos permanecieron viables y respondieron a los estímulos ambientales incluso después de la mineralización. La obra abre un camino para crear vida, compuestos orgánicos-inorgánicos funcionales con características de adaptación y autorreparación con aplicaciones en biomedicina, medicina regenerativa, y biorremediación.
© 2020 Science X Network