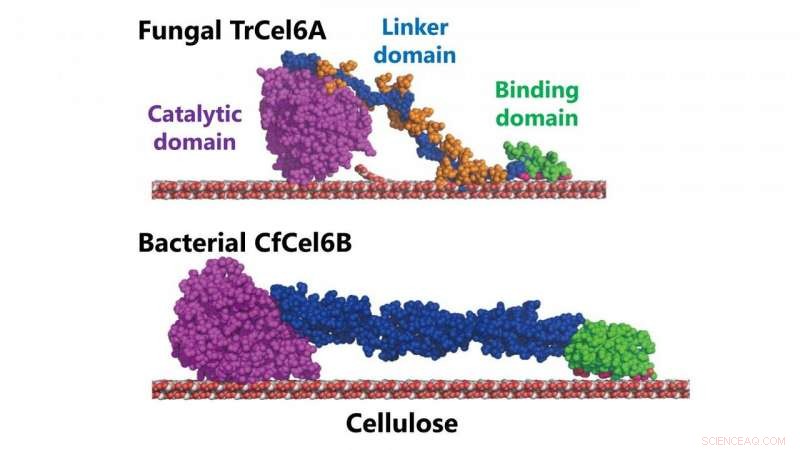
Modelos estructurales de celobiohidrolasas fúngicas y bacterianas (TrCel6A, CfCel6B) Crédito:NINS / IMS
Los esfuerzos para encontrar formas de descomponer la celulosa, el material resistente que forma las paredes celulares de las plantas, de manera más rápida y productiva ha sido durante mucho tiempo un objetivo de los investigadores industriales.
Cuando las plantas se procesan en biocombustibles u otras aplicaciones de biomasa, la celulosa debe degradarse primero en moléculas de azúcar más simples, y este paso puede representar hasta una cuarta parte de los costos operativos y de capital de la producción de biocombustible. Si este proceso puede hacerse más rápido y productivo, no solo ahorrará dinero a la industria, pero estas eficiencias también podrían reducir el impacto ambiental de la producción.
Las moléculas de celulosa se unen muy fuertemente entre sí, haciendo que la celulosa sea muy difícil de degradar. Algunos hongos pueden descomponerlo, sin embargo, y sus sistemas de degradación de celulosa son bien conocidos.
Los hongos producen muchos tipos de celulasas —Enzimas que aceleran la reacción química que degrada la celulosa. Y estos hongos se han utilizado ampliamente en la industria por este motivo. Por ejemplo, el hongo Trichoderma reesei —Descubierto durante la Segunda Guerra Mundial en el Pacífico como resultado de su destrucción de tiendas de campaña y ropa— se utiliza en la producción de jeans lavados a la piedra. Celobiohidrolasa , un tipo de celulasa que produce el hongo, descompone la celulosa en celobiosa, un azúcar simple más fácilmente utilizable por los organismos. Esto degrada ligeramente el material de mezclilla en algunos lugares, lo que a su vez lo suaviza, haciéndolo parecer lavado con piedras, y lo hace más cómodo de llevar.
Pero hay otro tipo de sistema de degradación de celulosa utilizado por algunas bacterias, y que es similar en muchos aspectos al utilizado por este hongo. Pero este sistema no se ha entendido muy bien hasta ahora. En un papel en el Revista de química biológica el 18 de agosto investigadores del Instituto de Ciencia Molecular de Japón, Institutos Nacionales de Ciencias Naturales (IMS, NINS) han descrito finalmente este sistema en detalle a nivel de molécula única.
El tipo de celobiohidrolasa producida por la bacteria. Cellulomonas fimi tiene un dominio catalítico similar a la celobiohidrolasa producida por T. reesei . El dominio catalítico de una enzima es su región que interactúa con una molécula que quiere cambiar o descomponer (para provocar la reacción enzimática). Tanto el hongo como el sistema de degradación de la celulosa de las bacterias también exhiben una actividad hidrolítica similar (la forma en que usan el agua para romper los enlaces químicos de la celulosa).
Pero los dos sistemas tienen diferentes módulos de unión a carbohidratos (la serie de proteínas en la enzima que se unen a los carbohidratos en la celulosa) y lo que se denominan "enlazadores". en esencia, la parte de la enzima que une el dominio catalítico a los módulos de unión a carbohidratos.
En investigaciones anteriores, Los científicos del NINS ya habían establecido que la estructura de la región enlazadora de la celobiohidrolasa fúngica desempeñaba un papel crucial en la rapidez con la que la enzima se une a la celulosa (y por lo tanto la rapidez con la que el sistema degrada la celulosa).
"Así que las siguientes preguntas obvias fueron:aunque estas otras partes de la celobiohidrolasa de la bacteria son diferentes a las del hongo, ¿Sin embargo hacen algo similar? ", dijeron Akihiko Nakamura y Ryota Iino, los investigadores del equipo. "¿También aceleran la degradación de la celulosa?"
Descubrieron que sí. Los científicos utilizaron imágenes de fluorescencia de una sola molécula, un método avanzado de microscopía que ofrece imágenes de células vivas con una resolución de solo decenas de nanómetros, para observar la celobiohidrolasa de la bacteria que se une y se disocia de las moléculas de celulosa.
Esto les permitió aclarar las funciones de las diferentes partes del sistema de degradación de la celulosa. Descubrieron que los módulos de unión a carbohidratos eran de hecho importantes para la unión inicial, pero el papel desempeñado por la región enlazadora fue bastante menor.
Sin embargo, encontraron que el dominio catalítico no era tan similar después de todo. Su estructura mostraba bucles más largos en la entrada y salida de un "túnel" en el corazón del sistema en comparación con el del hongo. Y esta diferencia en la estructura del túnel da como resultado una mayor procesividad:la capacidad de una enzima para desencadenar múltiples reacciones consecutivas.
Los próximos pasos serán diseñar estas enzimas que degradan la celulosa bacteriana para descomponer la celulosa más rápidamente.