
Un ejemplo de lo pequeño electrodo de flujo continuo que los investigadores de Duke utilizaron para producir más hidrógeno a partir de la electrólisis con un centavo por escala. Crédito:Wiley Lab, Universidad de Duke
Electrólisis, pasar una corriente a través del agua para romperla en hidrógeno y oxígeno gaseosos, podría ser una forma práctica de almacenar el exceso de energía de la energía eólica o solar. El hidrógeno se puede almacenar y utilizar como combustible más tarde, cuando el sol se pone o los vientos están tranquilos.
Desafortunadamente, sin algún tipo de almacenamiento de energía asequible como este, Cada año se desperdician miles de millones de vatios de energía renovable.
Para que el hidrógeno sea la solución al problema del almacenamiento, La electrólisis por división de agua tendría que ser mucho más asequible y eficiente, dijo Ben Wiley, profesor de química en la Universidad de Duke. Y él y su equipo tienen algunas ideas sobre cómo lograrlo.
Wiley y su laboratorio probaron recientemente tres nuevos materiales que podrían usarse como un poroso, electrodo de flujo continuo para mejorar la eficiencia de la electrólisis. Su objetivo era aumentar el área de superficie del electrodo para reacciones, evitando atrapar las burbujas de gas que se producen.
"La velocidad máxima a la que se produce el hidrógeno está limitada por las burbujas que bloquean el electrodo, que literalmente impiden que el agua llegue a la superficie y se parta, "Dijo Wiley.
En un documento que apareció el 25 de mayo en Materiales energéticos avanzados , compararon tres configuraciones diferentes de un electrodo poroso a través del cual el agua alcalina puede fluir a medida que ocurre la reacción.
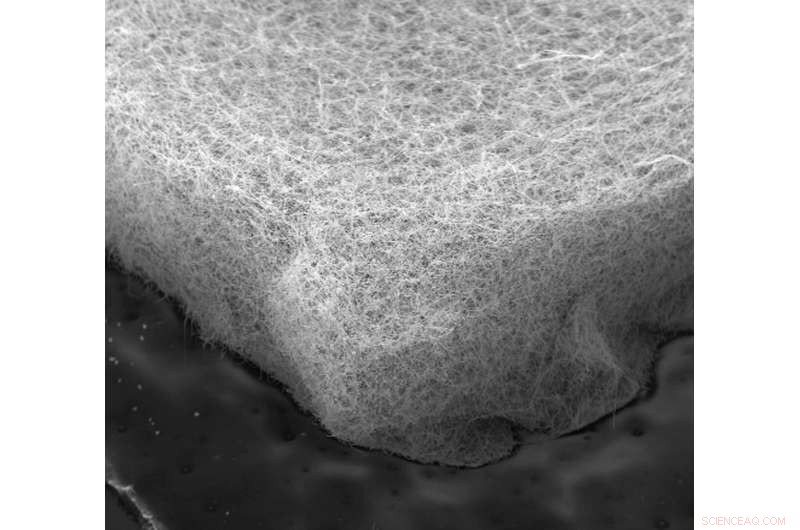
Una vista microscópica del material de fieltro de níquel que optimizó el área de superficie y la liberación de burbujas a medida que producía hidrógeno a partir de la electrólisis. Crédito:Wiley Lab, Universidad de Duke
Fabricaron tres tipos de electrodos de flujo continuo, cada uno un cuadrado de 4 milímetros de material similar a una esponja, solo un milímetro de espesor. Uno estaba hecho de espuma de níquel, uno era un 'fieltro' hecho de microfibras de níquel, y el tercero era un fieltro hecho de nanocables de níquel-cobre.
Corriente pulsante a través de los electrodos durante cinco minutos, cinco minutos de descanso, encontraron que el fieltro hecho de nanocables de níquel-cobre inicialmente producía hidrógeno de manera más eficiente porque tenía una superficie mayor que los otros dos materiales. Pero en 30 segundos, su eficiencia se hundió porque el material se atascó con burbujas.
El electrodo de espuma de níquel fue mejor para dejar escapar las burbujas, pero tenía un área de superficie significativamente menor que los otros dos electrodos, haciéndolo menos productivo.
El punto óptimo resultó ser un fieltro de microfibra de níquel que producía más hidrógeno que el fieltro del nanoalambre. a pesar de tener un 25 por ciento menos de área superficial para la reacción.
En el transcurso de una prueba de 100 horas, el fieltro de microfibra produjo hidrógeno a una densidad de corriente de 25, 000 miliamperios por centímetro cuadrado. A ese ritmo, sería 50 veces más productivo que los electrolizadores alcalinos convencionales que se utilizan actualmente para la electrólisis del agua, calcularon los investigadores.

Una vista de microscopio electrónico del material de fieltro de níquel que optimizó el área de superficie y la liberación de burbujas a medida que producía hidrógeno a partir de la electrólisis. Crédito:Wiley Lab, Universidad de Duke
La forma más barata de producir cantidades industriales de hidrógeno en este momento no es dividiendo el agua, pero al romper el gas natural (metano) con vapor muy caliente, un enfoque de uso intensivo de energía que crea de 9 a 12 toneladas de C02 por cada tonelada de hidrógeno que produce, sin incluir la energía necesaria para crear vapor de 1000 grados Celsius.
Wiley dijo que los productores comerciales de electrolizadores de agua pueden realizar mejoras en la estructura de sus electrodos basándose en lo que su equipo ha aprendido. Si pudieran aumentar en gran medida la tasa de producción de hidrógeno, el costo del hidrógeno producido al dividir el agua podría bajar, tal vez incluso lo suficiente como para convertirlo en una solución de almacenamiento asequible para energía renovable.
También está trabajando con un grupo de estudiantes en el programa Bass Connections de Duke que están explorando si la electrólisis de flujo continuo podría ampliarse para producir hidrógeno a partir de la abundante energía solar de la India.