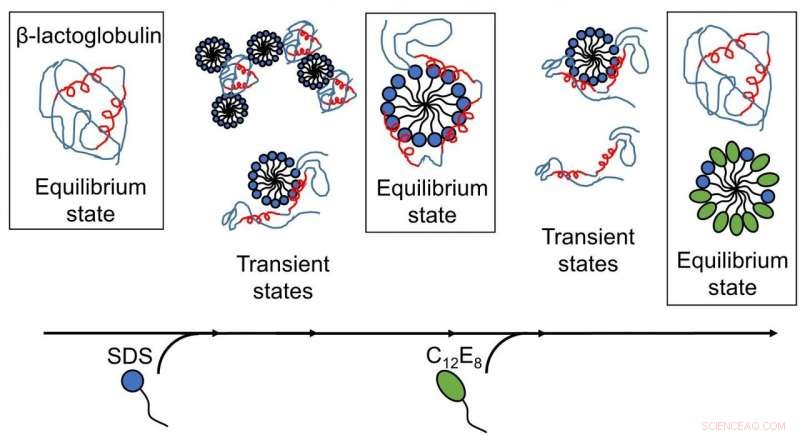
Los resultados publicados por investigadores de la UA revelan que el desplegamiento y replegamiento de proteínas mediado por surfactantes son procesos complejos con varias estructuras presentes. y los reordenamientos ocurren en escalas de tiempo desde submilisegundos hasta minutos. (Imagen:reproducida con permiso de la Royal Society of Chemistry). Crédito: Chem Sci , derechos de autor 2020 Royal Society of Chemistry.
Comprender las interacciones entre las proteínas y las moléculas de jabón (tensioactivos) ha sido durante mucho tiempo importante para la industria, particularmente en detergentes y cosméticos. Se sabe que el tensioactivo aniónico dodecilsulfato de sodio (SDS) despliega proteínas globulares, mientras que el tensioactivo no iónico octaetilenglicol monododecil éter (C12E8) hace lo contrario, es decir, ayuda a que las proteínas se vuelvan a doblar en forma.
Para que los detergentes en polvo funcionen de manera eficiente, es importante que los tensioactivos no cambien la estructura de las proteínas (enzimas), ya que cualquier cambio en la estructura de las enzimas mata su capacidad para eliminar las manchas y eliminar la suciedad. La mayoría de los detergentes en polvo contienen mezclas de tensioactivos que permiten que las enzimas permanezcan activas. También, algunas biotecnologías aprovechan los tensioactivos en combinación con proteínas.
Las proteínas de membrana generalmente se encuentran en la membrana celular. Con el fin de extraerlos de este entorno para diferentes estudios, tienen que solubilizarse con un tensioactivo. El tensioactivo tiene que ser "suave" y solo cubrir la parte de la proteína insertada en la membrana para que se conserve su estructura. A diferencia de, al caracterizar el peso molecular de las proteínas en el laboratorio, una técnica estándar es desplegarlos con el agresivo tensioactivo cargado negativamente, SDS, y monitorear cómo migran en un gel de polímero en un campo eléctrico. Esta técnica solo funciona si el surfactante despliega completamente las proteínas y destruye su estructura.
Todavía existe un debate sobre qué tipo de interacciones entre la proteína y el surfactante es más importante. ¿Son las interacciones electrostáticas entre las cargas del tensioactivo y la proteína, o son simplemente las propiedades de la interfaz de los agregados (micelas) que los tensioactivos forman en el agua, ¿Cuáles son los responsables del desdoblamiento de la proteína?
Si bien el desdoblamiento se ha estudiado en detalle a nivel de proteínas, En estos procesos falta una imagen completa de la interacción entre la proteína y el surfactante. Esta falta de conocimiento se aborda en el trabajo actual utilizando la proteína globular β-lactoglobulina (bLG) como proteína modelo.
La combinación correcta de técnicas experimentales
Se obtuvo una visión más profunda del despliegue y replegamiento de proteínas, ya que los diversos pasos de interacciones entre el tensioactivo y las proteínas se trazaron en función del tiempo. Primeramente, la proteína modelo, bLG, se mezcló con el tensioactivo aniónico SDS mientras se seguía la evolución temporal de la formación de complejos entre proteínas y moléculas de tensioactivo en la escala de tiempo de milisegundos-minuto. Con esto, los investigadores han determinado la estructura de los complejos en evolución. Posteriormente, mapearon el curso temporal del proceso de replegamiento cuando se añadió tensioactivo no cargado (C12E8) a una muestra que contenía complejos de SDS y proteína.
Para observar cómo se reordena la proteína durante el proceso de desplegado y replegamiento inducido por los tensioactivos, técnicas espectroscópicas complementarias, dicroísmo circular y fluorescencia de triptófano, se utilizaron en combinación con la dispersión de rayos X de ángulo pequeño con resolución temporal (SAXS).
El dicroísmo circular y la fluorescencia del triptófano controlan los cambios en la estructura de bLG, mientras que los cambios en la forma general de los complejos de proteína-surfactante fueron seguidos por sincrotrón SAXS. Esta combinación de técnicas no se ha utilizado antes para estudiar estos procesos.
Procesos complejos que duran desde milisegundos hasta minutos
El desdoblamiento de la proteína por SDS fue un proceso homogéneo, donde todas las moléculas de proteína siguen la misma ruta de despliegue. Los complejos de SDS (micelas) atacan a las moléculas de proteína de frente y luego despliegan gradualmente la proteína para que forme una capa alrededor de la micela de SDS. El replegamiento comienza cuando las micelas C12E8 "succionan" SDS del complejo proteína-SDS para formar micelas mixtas SDS-C12E8. Sin embargo, el proceso de replegamiento real parece seguir varias rutas, dado que se encontraron múltiples estructuras que se formaron en paralelo, namely protein-surfactant complexes (probably containing both SDS and C12E8), mixed micelles of SDS and C12E8, "naked" proteins unfolded like long polymeric chains, and properly folded proteins. The experiment allowed the interconversion between these species to be followed, so that it could be determined which of the processes are fast and which ones are slow. The folded protein could form both from the naked unfolded proteins (quickly) and from protein-surfactant complexes (more slowly). Por lo tanto, the best way in which surfactants can help a protein to fold is to basically get out of the way and let the protein find its own way back to the folded state.
The results have provided deeper insight into the structural changes occurring at the protein-surfactant level. They revealed that surfactant-mediated unfolding and refolding of proteins are complex processes of rearrangements occurring on time scales from below milliseconds to minutes and involve intimate collaboration between surfactant complexes and proteins.