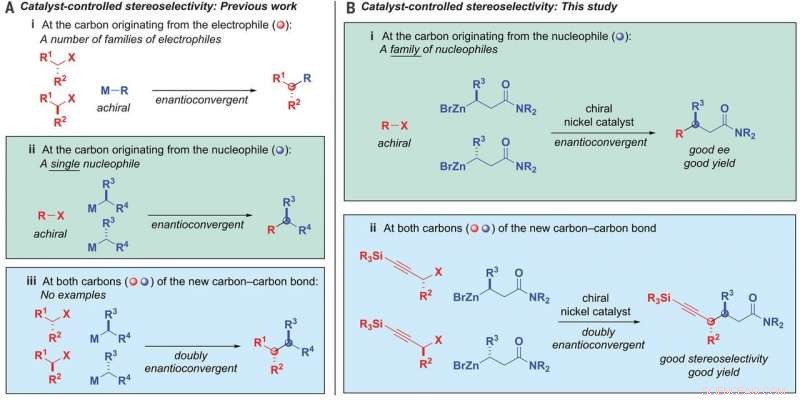
Formación de enlaces alquil-alquilo. (A) Estereoselectividad controlada por catalizador:trabajo previo. (B) Estereoselectividad controlada por catalizador:este estudio. ee, exceso enantiomérico; METRO, metal; R, sustituyente; X, saliendo del grupo. Crédito: Ciencias (2020). DOI:10.1126 / science.aaz3855
Un equipo de investigadores del Instituto de Tecnología de California ha encontrado un catalizador de níquel que une a los alquil nucleófilos y alquil electrófilos para formar un solo estereoisómero con dos centros quirales. En su artículo publicado en la revista Ciencias , el grupo describe su proceso. Jianyu Xu y Mary Watson de la Universidad de Delaware han publicado un artículo en perspectiva sobre el trabajo realizado por el equipo en la misma edición de la revista.
En Quimica, Las reacciones que dan como resultado materiales con enlaces carbono-carbono son deseables porque se utilizan en aplicaciones a gran escala, como productos farmacéuticos y agrícolas. Tales reacciones generalmente se basan en catalizadores basados en metales de transición, pero existen limitaciones que impiden que se usen muchos. Muchos solo funcionan con compuestos de alquilo, que puede dar lugar a reacciones secundarias indeseables. También, muchas de estas reacciones dan como resultado mezclas racémicas de productos, resultando en ineficiencias (las mezclas racémicas son aquellas que tienen cantidades iguales de enantiómeros izquierdos y derechos de una molécula quiral).
Históricamente, se ha considerado muy difícil vincular mezclas racémicas de dos alquilos mientras se mantiene el control de la estereoquímica de ambos extremos del producto. Pero ahora, eso ha cambiado, gracias al trabajo del equipo de CIT, y eso ha llevado a un método para llevar a cabo reacciones que conducen a materiales con enlaces carbono-carbono deseables.
En su trabajo, el equipo desarrolló un catalizador de níquel que permite que un alquil nucleófilo se una a un alquil electrófilo. Notablemente, ambos son compuestos de carbono racémicos. Utilizaron un ligando que era bidentado, que permitía que los puntos abiertos del níquel se unieran al oxígeno de los nucleófilos.
La reacción también implicó el uso de nucleófilos amida β-zincados y electrófilos de haluro propargílico. Y fue controlado por el catalizador. Al anular la información quiral en ambos productos iniciales y luego volver a unirlos de una manera predefinida, se formaron los enlaces carbono-carbono. El resultado fue un solo estereoisómero que tenía dos centros quirales. Al usar el catalizador de níquel, el grupo acopló una mezcla racémica con nucleófilos y electrófilos con hasta 95 por ciento de estereoselectividad y 82 por ciento de rendimiento. Las pruebas también mostraron que era compatible con 19 grupos funcionales.
© 2020 Science X Network