Crédito:Laboratorio Nacional del Noroeste del Pacífico
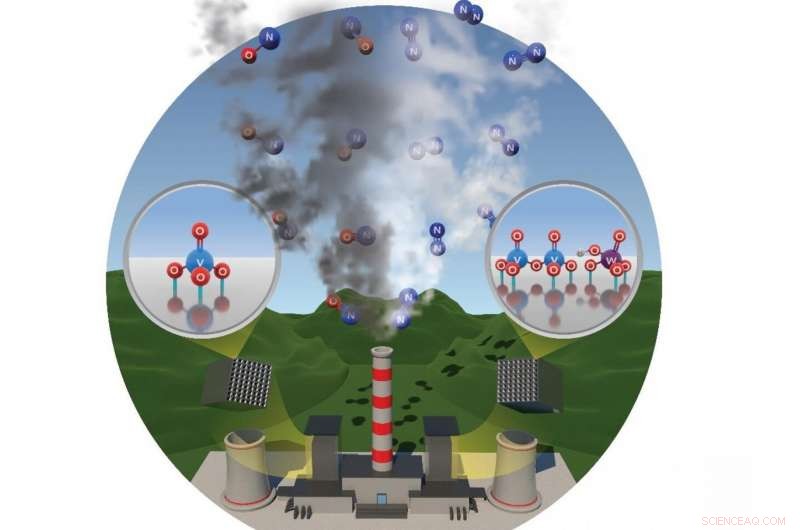
Oxido de nitrógeno, también conocido como NO X , se forman cuando los combustibles fósiles se queman a altas temperaturas. Cuando se emite de fuentes industriales como centrales eléctricas de carbón, estos contaminantes reaccionan con otros compuestos para producir smog dañino. Para mitigar estos NO X emisiones, Los ingenieros desarrollaron un proceso llamado reducción catalítica selectiva (SCR) donde NO X pasa por un convertidor, o depurador de aire, que transforma el químico peligroso en gas nitrógeno inofensivo.
Si bien SCR no es nuevo, la química subyacente de los óxidos metálicos utilizados en el proceso seguía siendo desconocida, hasta ahora. Un equipo de investigación dirigido por el químico de PNNL Jian Zhi Hu, junto con colaboradores de múltiples universidades, ha descrito de forma decisiva cómo se disponen los óxidos metálicos.
"El funcionamiento de una reacción tiene implicaciones cuando intentamos diseñar materiales aún mejores, "dijo Nicholas Jaegers, el primer autor del artículo y estudiante de doctorado en la Universidad Estatal de Washington. "Si podemos identificar una tendencia de lo que está funcionando específicamente a nivel molecular, entonces podríamos alterar el sistema para tener más de los efectos que queremos o aplicar eso a otras reacciones con los mismos requisitos de actividad ". Jaegers es un estudiante en el laboratorio del profesor Yong Wang, el científico principal que dirige la investigación.
El rompimiento
Como en muchas relaciones tóxicas, nitrógeno y oxígeno, los dos elementos benignos que componen el NO X —Son peligrosos juntos, y, una vez unidos, difícil de separar. El catalizador adecuado facilita la ruptura, y en las condiciones adecuadas, ayuda a que los átomos se separen aún más rápido.
Las unidades SCR diseñadas para descomponer NO X en las centrales eléctricas u otras instalaciones de combustión estacionarias están hechas de una celosía de soporte de óxido de titanio con óxido de vanadio y óxido de tungsteno en la parte superior. NO X no se dividirá sin un catalizador como el óxido de vanadio, pero la división es más rápida y completa cuando se agrega óxido de tungsteno.
Los científicos especularon que el papel del tungsteno era estructural y no una parte directa del sitio activo en la reacción. pero no podían estar seguros sin saber qué estaba sucediendo a nivel molecular.
Hasta ahora, los límites de la medición de estructuras moleculares impidieron comprender cómo funcionaba la reacción. Muchas técnicas pueden detectar la presencia de ciertos elementos, sus concentraciones, y sus estados químicos. Esos métodos, sin embargo, degradan las muestras experimentales o carecen de la precisión para hacer una afirmación definitiva sobre si una molécula existe sola o dentro de un acoplamiento o un grupo. El equipo superó estas limitaciones con una combinación de resonancia magnética nuclear giratoria de ángulo mágico de alta velocidad (MAS NMR), pruebas de reactividad, y modelado computacional para hacer su descubrimiento.
"Para encontrar esta evidencia, MAS NMR es absolutamente necesario, "dijo Karl Mueller, director de ciencia y tecnología de la Dirección de Ciencias Físicas y Computacionales de la PNNL. El instrumento, financiado por el Departamento de Ciencias Energéticas Básicas de la Energía, permitió a los científicos sacar conclusiones decisivas sobre las estructuras moleculares responsables de la reacción catalítica.
Buscando una señal
MAS NMR funciona haciendo girar una muestra en un fuerte campo magnético en un ángulo específico y disparando ondas de radio a través de ella para excitar y detectar las frecuencias de resonancia de los espines nucleares asociados con los átomos. Debido a que cada átomo tiene una frecuencia diferente, las olas energizan solo los elementos objetivo. Cada átomo envía una respuesta que revela su ubicación y qué hay a su alrededor. Con base en esa respuesta, y cuán detallada es, los científicos pueden comprender la estructura de un material.
MAS NMR es particularmente sensible a los cambios estructurales en materiales que contienen vanadio, pero el equipo no sabía qué respuestas esperar de diferentes disposiciones de óxido de vanadio. En estrecha colaboración con el equipo de David Dixon de la Universidad de Alabama, modelaron las respuestas de salida para varios arreglos de vanadio, luego hizo coincidir los resultados modelados con los resultados de MAS NMR. Esta comparación permitió a los investigadores identificar las estructuras de la superficie.
El equipo descubrió que los óxidos de vanadio individuales no adheridos, también conocidos como monómeros, fueron relativamente lentos en permitir que el NO X reacción para continuar. Sin embargo, pairs or clusters of vanadium oxides—close together on the titanium support—dramatically increased the reaction efficiency. This was precisely determined by Professor Israel Wachs' group from Lehigh University.
The team also learned the tungsten was necessary not for its reactive properties, but because it encouraged the vanadium oxides to arrange into the reactive clusters. Unlike isolated vanadium oxide monomers, vanadium clusters work better because they provide several active sites working together to make the reaction go faster. The study shows that the reaction needs two sites closer together to work.
Con la estructura en mano, the next step is to understand why the tungsten-promoted reaction is more stable. Con ese fin, the team is now studying how the reaction could be different in an aged versus fresh SCR unit and, entre otras cosas, how water might affect the reaction. A tiempo, these findings may influence how SCR units are made.
Results of the study appear in the journal Angewandte Chemie .