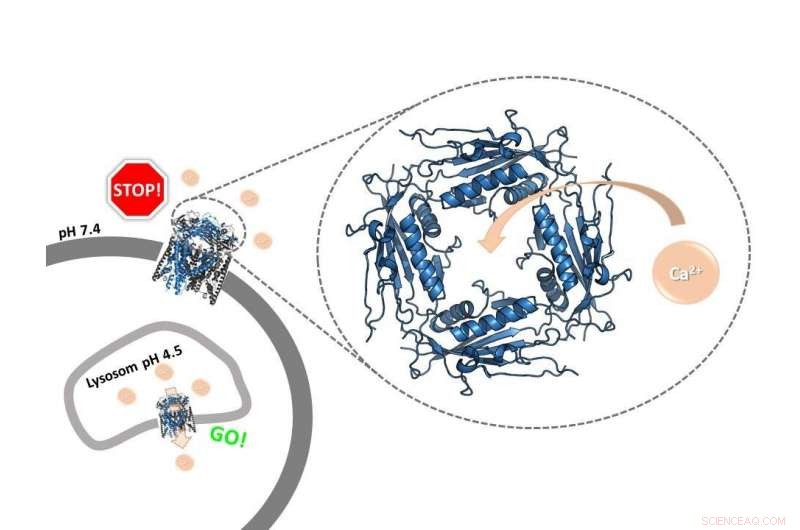
Un anillo de portero:el dominio extracitosólico / lumenal del canal iónico TRPML2 humano, cuya estructura el presente estudio elucida por primera vez, funciona como un controlador de calcio dependiente del pH. Regula la función del canal en diferentes compartimentos celulares. Crédito:Kerstin K. Viet
Los canales de iones son poros en la membrana de las células u orgánulos celulares. Permiten partículas cargadas positiva o negativamente, los llamados iones, para ser transportado a través de la membrana. Los bioquímicos de la Universidad Johannes Gutenberg de Mainz (JGU) ahora han logrado obtener imágenes de una importante región reguladora del canal de iones de calcio humano TRPML2 a alta resolución. un área del canal con forma de anillo grande en un lado de la membrana. Este anillo actúa como un portero decidir si los iones pueden moverse a través del canal. "Nuestro estudio ha revelado la estructura del anillo, que también se llama dominio extracitosólico / lumenal (ELD), en canales TRPML2 humanos, y también que es este dominio el responsable de la interacción del canal con el calcio, ", dijo la profesora Ute Hellmich del Instituto de Farmacia y Bioquímica de JGU — Ciencias biológicas terapéuticas. Dependiendo del valor de pH, los iones de calcio pueden abrir o bloquear el canal, y por tanto controlar su transporte a través de las membranas celulares.
El grupo de investigación de Hellmich investigó qué propiedades estructurales del anillo del canal de iones son responsables de permitir el paso de los iones de calcio. "El calcio es un mensajero celular importante que también desempeña un papel en muchas enfermedades, "explicó Hellmich. El elemento realiza numerosas tareas en el cuerpo, incluida la regulación de las enzimas y la ayuda con la fusión de membranas.
TRPML2, abreviatura de potencial receptor transitorio mucolipina 2, es un canal iónico de la subfamilia de mucolipinas de los canales TRP implicados en la percepción sensorial en humanos. TRPML2 juega un papel en la respuesta inmune a las infecciones y aumenta la infectividad de los virus del Zika y el dengue. Además, Las mutaciones en los canales iónicos TRPML pueden provocar ceguera, sordera, y daño neurológico en humanos.
El valor del pH es crucial para la actividad del canal iónico.
Como deja claro Hellmich, Los canales de iones no son simples orificios. Pueden abrirse y cerrarse activamente. Esta, Sucesivamente, activa y controla las vías celulares. "Ahora hemos descubierto que la unión del calcio al dominio extracitosólico / lumenal de TRPML2 en la parte superior del canal depende del pH, "declaró Kerstin Viet, primer autor del artículo en la revista científica Estructura . Esta investigación formó parte de su tesis de maestría y resultó en la concesión del Premio de la Fundación Adolf Todt.
A un valor de pH más alto de alrededor de siete, encontrado en el exterior de la celda, los iones de calcio pueden unirse al anillo y así bloquearlo. En cambio, los iones de calcio ya no pueden bloquear la abertura a un pH más bajo típico de ciertos compartimentos intracelulares. "El anillo actúa como un guardián del resto del canal iónico, "dijo Viet.
Por lo tanto, esto regula la actividad del canal:es importante que el canal de iones solo se active dentro de la célula, donde el pH es generalmente bajo; en efecto, el canal sólo se abre cuando un mecanismo celular particular indica que requiere calcio. La activación involuntaria en la superficie de la célula bien podría resultar en daños a la célula. "El mecanismo de regulación es inteligente. También es relevante, por ejemplo, a cómo reacciona la célula a una infección viral, "dijo Hellmich, agregando que todo el proceso, cuándo y cómo se abre o se cierra un canal iónico, aún no se comprende completamente. Los otros dos canales iónicos de la subfamilia de mucolipinas humanas, TRPML1 y TRPML3, También tiene un anillo de portero similar. Por tanto, los resultados del estudio permiten por primera vez comparar los tres subtipos.