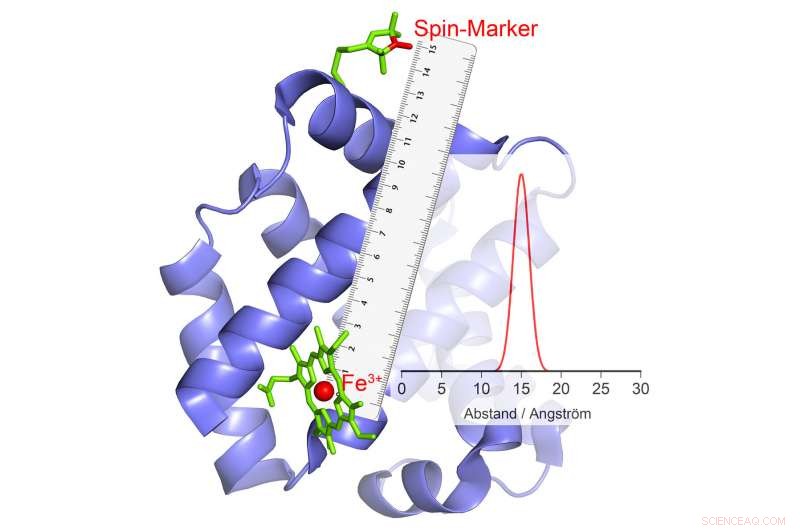
Si cambia su polaridad, esto provoca un eco en el marcador magnético, a partir del cual se puede calcular la distancia. Crédito:© AG Schiemann / Uni Bonn
Los científicos de la Universidad de Bonn han desarrollado un método con el que se puede "fotografiar" una enzima en acción. Su método permite comprender mejor la función de biomoléculas importantes. Los investigadores también esperan conocer las causas de ciertos trastornos enzimáticos. El estudio se publicará en la revista Química:una revista europea .
Si un extraterrestre vio una imagen de un par de tijeras por primera vez en un catálogo de suministros para manualidades, probablemente no tendría idea de para qué usamos esto los terrícolas. Si, por otra parte, le iban a mostrar un video en el que las tijeras se abren y se cierran, tal vez podría deducir su función con un poco de imaginación.
Los científicos tienen un enfoque muy similar cuando quieren comprender cómo funciona una enzima:si conocen la estructura de la molécula, luego, por lo general, solo como una imagen fija. No saben cómo se comporta la enzima en acción, qué partes se acercan y qué partes se alejan.
Las enzimas catalizan ciertas reacciones químicas en las células, comparable a las tijeras que cortan papel. Tienen centros catalíticos (las cuchillas) que entran en contacto con el material de partida (el papel). "La forma tridimensional de la enzima generalmente cambia durante este proceso, "explica el Prof. Dr. Olav Schiemann del Instituto de Química Física y Teórica de la Universidad de Bonn." Normalmente, estos cambios conformacionales no se pueden hacer visibles, o solo con gran esfuerzo. Esto a menudo dificulta la comprensión del mecanismo de catálisis ".
El grupo de investigación de Schiemann ha logrado desarrollar un método con el que se pueden medir los movimientos de partes de la proteína entre sí en el curso de la catálisis. Los científicos de Bonn han estado trabajando en estos métodos con gran éxito durante varios años. En su estudio actual, han examinado un grupo de enzimas particularmente importante. Estos transportan iones metálicos con numerosos electrones desapareados en sus centros catalíticos. Un ejemplo es la hemoglobina, que se une al oxígeno con la ayuda de un ión de hierro y, por lo tanto, puede transportarse en la sangre.
Voltear iones
"Nuestros métodos actuales no son adecuados para iones de tan alto giro, "explica el colega de Schiemann, el Dr. Dinar Abdullin." Por lo tanto, desarrollamos un nuevo método, desarrollaron la teoría y la probaron con éxito ". Los investigadores aprovecharon el hecho de que los iones de alto espín se comportan como pequeños electroimanes. Además, pueden cambiar aleatoriamente su polaridad, se "voltean":el Polo Norte se convierte en el Polo Sur y el Polo Sur se convierte en el Polo Norte.
Este fenómeno se puede utilizar para medir distancias. Aquí, los científicos relacionan la enzima con ciertos compuestos químicos que también tienen propiedades electromagnéticas. "Cuando los iones de alta rotación se mueven, estos pequeños electroimanes reaccionan al campo magnético modificado en su entorno cambiando también su polaridad, "explica Abdullin. Cuándo y cómo lo hacen depende, entre otras cosas, en la distancia al ion de alto espín. Esto hace posible determinar la distancia entre los dos con tanta precisión.
Si varios grupos magnéticos están unidos a una enzima, Se obtiene la distancia de cada uno de estos grupos al ion de alto espín y, por tanto, al centro catalítico. "Al combinar estos valores, podemos medir la posición espacial de este centro, como si estuviéramos usando un GPS molecular, "explica Schiemann." Por ejemplo, podemos determinar cómo cambia su posición en relación con los otros grupos magnéticos en el curso de la catálisis ".
Sin embargo, los científicos aún no pueden observar realmente cómo funciona la enzima. "Seguimos trabajando con células congeladas, ", dice Schiemann." Estos contienen numerosas enzimas que se congelaron en diferentes momentos durante la reacción catalítica. Entonces no obtenemos una película, sino una serie de "imágenes fijas", como si las tijeras del ejemplo introductorio fueran fotografiadas en innumerables momentos diferentes durante el proceso de edición.
"Pero ya estamos trabajando en la próxima mejora, Enfatiza el químico:"La medición espacial de biomoléculas en las células ya temperatura ambiente". Los investigadores esperan conocer el desarrollo de ciertas enfermedades que son desencadenadas por trastornos funcionales de las enzimas.